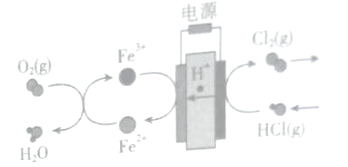
题目内容
【题目】某无色透明溶液中可能存在大量Ag+、Mg2+、Fe3+、Cu2+中的一种或几种,请填写下列空白。
(1)不用做任何实验就可以肯定溶液中不存在的离子是________________。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明原溶液中肯定存在的离子是_______,有关反应的离子方程式为___________。
(3)取(2)的滤液加过量的NaOH溶液,出现白色沉淀,说明原溶液中肯定有________,有关反应的离子方程式为_________________________。
(4)原溶液中可能大量存在的阴离子是________(填序号)。
A.Cl- B.NO3- C. CO32- D.OH-
【答案】Fe3+、![]() Ag+ Ag++Cl-=AgCl↓ Mg2+ Mg2++2OH-=Mg(OH)2↓ B
Ag+ Ag++Cl-=AgCl↓ Mg2+ Mg2++2OH-=Mg(OH)2↓ B
【解析】
(1)有颜色的离子不用做实验就能判断是否存在;
(2)加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明含有Ag+;
(3)能和NaOH溶液反应的离子是Mg2+;
(4)有颜色的离子不用做实验就能判断是否存在,溶液中一定含银离子,与银离子结合生成沉淀的不能存在,根据离子共存结合溶液电中性原理确定离子的存在情况即可。
(1)有颜色的离子不用做实验就能判断是否存在,Cu2+水溶液显蓝色,Fe3+水溶液显黄色,因此这两种离子在无色溶液中不能大量存在,即不需要作实验就可以确定溶液中不含Cu2+、Fe3+;
(2)加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明含有Ag+,该反应的离子反应方程式为Ag++Cl-=AgCl↓;
(3)能和NaOH溶液反应的离子是Mg2+,离子反应方程式为Mg2++2OH-═Mg(OH)2↓;
(4)根据上述推断可知:在原溶液中存在Ag+,则由于Ag+、Cl-会发生离子反应形成沉淀而不能大量共存,因此溶液中不能存在Cl-,原溶液中含有Mg2+,Mg2+与CO32-、OH-会发生离子反应而不能大量共存,因此不能含有CO32-、OH-,NO3-不与所给的任何离子发生反应,因此溶液中可能大量存在的离子是NO3-,故合理选项是B。