题目内容
19.已知一种C(H+)=1×10-3mol•L-1的酸和一种C(OH-)=1×10-3mol•L-1的碱溶液等体积混合后溶液显碱性,其原因可能是( )| A. | 浓的强酸和稀的强碱溶液反应 | |
| B. | 生成了一种强碱弱酸盐 | |
| C. | 浓的弱碱和稀的强酸溶液反应 | |
| D. | 等物质的量浓度的一元弱酸和一元强碱溶液反应 |
分析 若为强酸与强碱溶液反应,则混合液为中性;若酸为强酸,碱为弱碱,反应生成强酸弱碱盐,则混合液碱过量,混合液显示碱性;若酸为弱酸,则酸过量,混合液显示酸性,据此进行判断.
解答 解:A.强碱、强酸在溶液中完全电离,则两溶液等体积混合后溶液中性中性,溶液的pH=7,不会为酸性,故A错误;
B.生成强碱弱酸盐,则酸为弱酸,存在电离平衡,等体积混合后混合液显示酸性,故B错误;
C.浓的弱碱和稀的强酸溶液反应,弱碱在溶液中部分电离,则弱碱的浓度大于1×10-3mol•L-1,则混合液中碱过量,混合液为碱性,故C正确;
D.若为一元弱酸,则酸溶液的浓度大于1×10-3mol•L-1,两溶液混合后酸过量,混合液显示酸性,故D错误;
故选C.
点评 本题考查酸碱混合时的定性判断及有关pH的计算,题目难度中等,注意根据n(H+)与n(OH-)关系以及反应后溶液的酸碱性判断酸碱的强弱关系,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
9.下列有关海水综合利用的说法正确的是( )
| A. | 电解饱和食盐水可制得金属钠 | B. | 海水提溴涉及到氧化还原反应 | ||
| C. | 海带提碘只涉及物理变化 | D. | 海水提镁不涉及复分解反应 |
10.下列金属中属于有色金属,且在常温下不溶于浓硝酸的是( )
| A. | 铁 | B. | 镁 | C. | 铝 | D. | 铜 |
7.下列各组中的离子,能在溶液中大量共存的是( )
| A. | H+、Ca2+、CO32-、Cl- | B. | H+、Fe2+、NO3-、OH- | ||
| C. | K+、Na+、Cl-、OH- | D. | Cu2+、Ba2+、Cl-、SO42- |
8.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.I配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,则需要称量NaOH固体质量为:5.0g.
(2)从图中选择称量NaOH固体所需要的仪器是(填字母):abe.
(1)若实验中大约要使用245mL NaOH溶液,则需要称量NaOH固体质量为:5.0g.
(2)从图中选择称量NaOH固体所需要的仪器是(填字母):abe.
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
9.下列说法中正确的是( )
| A. | 在标准状况下,1mol水的体积是22.4L | |
| B. | 1mol O2所占的体积为22.4L | |
| C. | 1mol任何气体所含的分子个数都是相同的 | |
| D. | 相同质量的N2和CO占有相同的体积 |
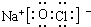 ;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式)OH-、H3O+.
;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式)OH-、H3O+. Fe(OH)3+3H+△H>0,平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀.
Fe(OH)3+3H+△H>0,平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀.