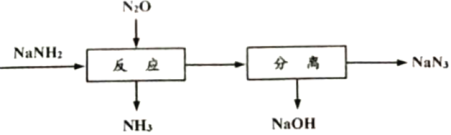
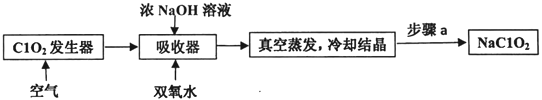
题目内容
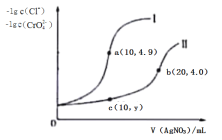
【题目】向某碳酸钠溶液中逐滴加1 mol·L-1的盐酸,测得溶液中Cl-、HCO3-的物质的量随加入盐酸体积的关系如图所示,其中n2∶n1=3∶2,则下列说法中正确的是

A. b点的数值为0.6
B. 该碳酸钠溶液中含有1 mol Na2CO3
C. b点时生成CO2的物质的量为0.3 mol
D. oa段反应的离子方程式与ab段反应的离子方程式相同
【答案】A
【解析】
将盐酸逐滴滴入碳酸钠溶液中,碳酸钠过量,首先发生的反应是Na2CO3+HCl=NaHCO3+NaCl,碳酸钠反应完后,再发生反应是NaHCO3+HCl=NaCl+CO2+H2O,据此分析解答。
A.a点全部生成碳酸氢钠,根据碳守恒,原溶液中含有0.5molNa2CO3,假设再加入xmolHCl,根据NaHCO3+HCl=NaCl+CO2+H2O,溶液中剩余(0.5-x)mol的HCO3-,则有![]() =
=![]() ,解得:x=0.1,即b点对应0.6molHCl,因为盐酸的物质的量浓度为1molL─1,所以b=0.6L, b点的数值为0.6,故A正确;
,解得:x=0.1,即b点对应0.6molHCl,因为盐酸的物质的量浓度为1molL─1,所以b=0.6L, b点的数值为0.6,故A正确;
B.a点全部生成碳酸氢钠,根据碳守恒,所以含有0.5molNa2CO3,故B错误;
C.Na2CO3+HCl=NaHCO3+NaCl,碳酸钠反应完后,再发生反应是NaHCO3+HCl=NaCl+CO2+H2O,可知a到b消耗盐酸的物质的量为:0.6-0.5=0.1mol,由HCO3-+H+=CO2↑+H2O可知,b点时生成CO2的物质的量为0.1mol,故C错误;
D.oa段反应的离子方程式为CO32-+H+=HCO3-,ab段反应的离子方程式为:HCO3-+H+=CO2↑+H2O,故D错误;
答案选A。

 阅读快车系列答案
阅读快车系列答案【题目】以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。其工作流程如下:
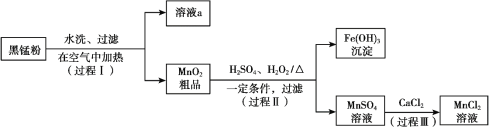
(1)过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。O2氧化MnO(OH)的化学方程式是_______。
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。
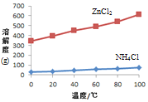
① 溶液a呈酸性,原因是______。
② 根据如图所示的溶解度曲线,将溶液a______(填操作),可得NH4Cl粗品。
③ 提纯NH4Cl粗品,有关性质数据如下:
化合物 | ZnCl2 | NH4Cl |
熔点 | 365℃ | 337.8℃分解 |
沸点 | 732℃ | ------------- |
根据上表,设计方案提纯NH4Cl:________。
(3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入_______(填试剂和现象),证明溶液中Fe3+沉淀完全。
(4)探究过程Ⅱ中MnO2溶解的适宜条件。
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:________。
② 解释试剂加入顺序不同,MnO2作用不同的原因:________。
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。
【题目】在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.增大压强使平衡向生成Z的方向移动,平衡常数增大
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.反应达平衡时,X的转化率为50%
D.改变温度可以改变此反应的平衡常数