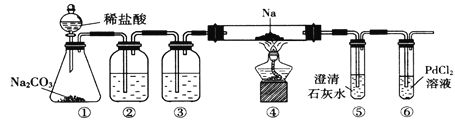
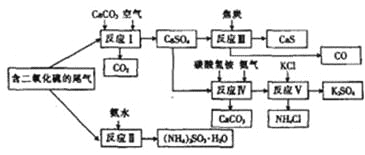
题目内容
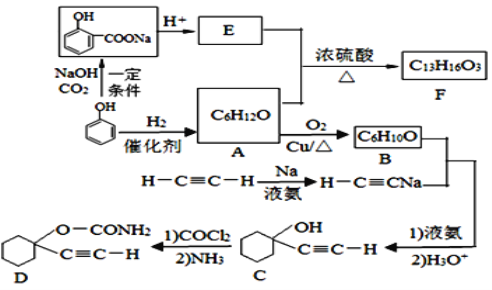
【题目】常温下,向10 mL 0.1 mol·L-1 NaCl溶液和10 mL 0.1 mol·L-1 K2CrO4溶液中分别滴加等物质的量浓度的AgNO3溶液,滴加过程中有关物理量的关系如图所示。下列说法正确的是( )
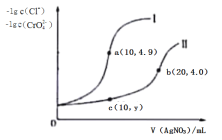
A.常温下Ksp(AgCl)的数量级为10-9
B.向c(Cl-)=c(CrO42-)的溶液中滴加AgNO3溶液,先得到Ag2CrO4沉淀
C.c点所示溶液中c(Ag+)≈1.3×10-5 mol·L-1
D.a、b两点存在沉淀的溶解平衡,而c点不在在此平衡
【答案】C
【解析】
A. 由图象提供数据可知:加入10 mLAgNO3溶液时,与NaCl溶液恰好反应;滴加20mLAgNO3溶液时可与K2CrO4溶液恰好反应,因此曲线I、II分别表示向NaCl、K2CrO4溶液中滴加AgNO3溶液的情况。a点时Cl-、Ag+恰好反应完,溶液中c(Cl-)=c(Ag+)=1×10-4.9,Ksp(AgCl)=1×10-9.8,数量级为10-10,A错误;
B. b点时恰好完全反应生成Ag2CrO4,c(CrO42-)=1×10-4.0 mol/L, c(Ag+)=2×10-4 mol/L,Ksp(Ag2CrO4)=4×10-12。由于开始时溶液中c(Cl-)=c(CrO42-),若要形成沉淀时,NaC1溶液中需要Ag+浓度c(Ag+)=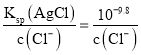 ,K2CrO4溶液中需要Ag+浓度c(Ag+)=
,K2CrO4溶液中需要Ag+浓度c(Ag+)=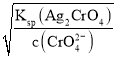 =
=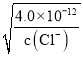 >
>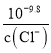 ,故向等浓度的混合溶液中滴加AgNO3溶液,先得到AgCl沉淀,B错误;
,故向等浓度的混合溶液中滴加AgNO3溶液,先得到AgCl沉淀,B错误;
C. c点时消耗掉一半的CrO42-,故剩余的c(CrO42-)=![]() =0.025mol/L,由此可求出c(Ag+)≈1.3×10-5mol/L,C正确;
=0.025mol/L,由此可求出c(Ag+)≈1.3×10-5mol/L,C正确;
D. 由于加入AgNO3溶液后体系中立即产生沉淀,故两条曲线上所示的点均对应沉淀的溶解平衡,D错误;
故合理选项是C。

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案