题目内容
【题目】叠氮化钠(NaN3)可用于汽车安全气囊的产气药。一种由氨基化钠(NaNH2)制备NaN3的工艺流程如下:
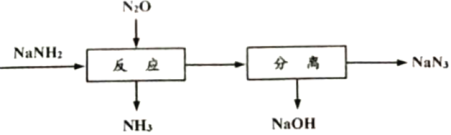
(1)生产NaNH2的化学方程式为2Na+ 2NH3(液)= 2NaNH2+ H2↑。
①钠元素位于周期表第___________周期___________族。
②NaNH2中氮元素的化合价为___________.
(2) NaOH的电子式为___________, 流程中“反应”的化学方程式为___________。
(3) NaN3晶体属于_____________(填 “离子”、“分子”或“原子”)晶体,NaN3在撞击时能发生分解反应生成两种单质。计算理论上65gNaN3完全分解,释放出标准状况下的气体体积_________(写出计算过程)。
【答案】三 ⅠA -3 ![]() 2NaNH2+N2O=NaN3+NaOH+NH3 离子 33.6L
2NaNH2+N2O=NaN3+NaOH+NH3 离子 33.6L
【解析】
根据流程图可知,NaNH2与N2O反应可生成NaN3、NaOH、NH3,反应后NH3是气体,分离出体系,再将NaN3和NaOH进行分离,最终得到NaN3。
(1)①Na是第11号元素,在周期表中位于第三周期第ⅠA族;
②NaNH2中Na和H都是+1价,故N是-3价;
(2)NaOH是离子化合物,Na+与OH-之间为离子键,O和H之间为共价键,电子式为![]() ;流程中“反应”是NaNH2与N2O反应生成NaOH、NH3、NaN3,化学方程式为2NaNH2+N2O=NaN3+NaOH+NH3;
;流程中“反应”是NaNH2与N2O反应生成NaOH、NH3、NaN3,化学方程式为2NaNH2+N2O=NaN3+NaOH+NH3;
(3)NaN3是离子化合物,故它的晶体是离子晶体;NaN3在撞击时能发生分解反应生成两种单质,根据元素守恒,这两种单质是Na和N2,方程式为2NaN3![]() 2Na+3N2↑,65gNaN3的物质的量为
2Na+3N2↑,65gNaN3的物质的量为![]() ,则生成的N2为1.5mol,标况下的体积为
,则生成的N2为1.5mol,标况下的体积为![]() ;
;

【题目】下表为元素周期表的一部分,请参照元素①—⑩在表中的位置,用相应的化学用语回答下列问题;
① | |||||||
② | ③ | ④ | ⑤ | ||||
⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)表中用序号标出的10种元素中,非金属性最强元素的离子结构示意图是____________。
(2)④、⑦、⑩的离子半径由大到小的顺序为____________(用元素符号作答)。
(3)由表中④、⑥元素可以组成一种淡黄色的物质,画出该物质的电子式____________,该物质含有的化学键类型有____________。
(4)元素②的简单气态氢化物为X,0.1molX完成燃烧生成稳定氧化物时放出akJ的能量,写出X燃烧热的热化学方程式:____________。
(5)写出实验室制备氨气的反应方程式____________。
(6)一种氢气燃料电池的原理如图:
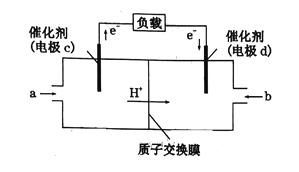
a极通入的气体是____________,正极的电极反应式为____________。
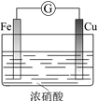
【题目】下列实验的现象与结论相对应的是
A | B | C | D | |
实验 |
|
|
|
|
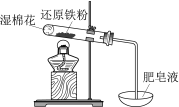
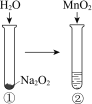
现象 | 电流计指针向右偏(电子由Fe转移到Cu),片刻后向左偏 | 加热一段时间后溶液蓝色褪去 | 加热,肥皂液中产生无色气泡 | ①和②中均迅速产生大量气泡 |
结论 | 铁片作负极,片刻后铜片作负极 | 淀粉在酸性条件下水解,产物是葡萄糖 | 铁粉与水蒸气反应生成H2 | MnO2一定是②中反应的催化剂 |
A.AB.BC.CD.D
【题目】下表列出了5种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ |
(1)①的元素符号是_______,⑤的原子结构示意图是__________;
(2)以上元素中,非金属性最强的是___________(填元素符号);
(3)④元素的最高价氧化物对应的水化物呈______性(填“酸”或“碱”或“两”);
(4)③④⑤三种元素按原子半径由大到小的顺序是______(填元素符号);
(5)元素①与元素②的单质氧化性较强的是________(填化学式)。;
(6)元素④的最高价氧化物与元素③的最高价氧化物对应的水化物相互反应的化学方程式__。