题目内容
4.由Cu、N、B、Ni等元素组成的新型材料有着广泛用途.(1)基态 Cu+的最外层核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10 .
(2)研究者预想合成一个纯粹由氮组成的新物种 N5+N3-,若N5+ 离子中每个氮原子均满足8电子结构,以下有关N5+ 推测正确的是C
A.N5+有24个电子
B. N5+离子中存在三对未成键的电子对
C. N5+阳离子中存在两个氮氮三键
(3)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3.通过3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得.
①与上述化学方程式有关的叙述不正确的是A.(填标号)
A.反应前后碳原子的轨道杂化类型不变
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形
C.第一电离能:N>O>C>B
D.化合物A中存在配位键
②1个(HB=NH)3分子中有12个σ键.
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式.图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为[BO2]nn-(或BO2-)图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为sp2、sp3.

(5)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为acm,则该晶体中距离最近的两个阳离子核间的距离为$\frac{\sqrt{2}}{2}$a(用含有a的代数式表示).在一定温度下,Ni0晶体可以自发地分散并形成“单分子层”(如图(c)),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为1.83×10-3g(氧离子的半径为1.40×10-10m,$\sqrt{3}$≈l.732).
分析 (1)Cu原子失去1个电子生成Cu+,Cu+核外有28个电子,失去的电子数是其最外层电子数,根据构造原理书写Cu+基态核外电子排布式;
(2)A.N5+是由N5分子失去1个电子得到的,1个N5分子是由5个氮原子构成的,据此进行分析解答.
B.N5+离子中每个氮原子均满足8电子结构,每个N原子形成3个共用电子对,还剩一对未成键电子;
C.N5+离子的结构为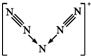 ;
;
(3)①由方程式可知:碳元素由CH4变为CO2,碳原子杂化类型由sp3转化为sp;
②根据无机苯中氮原子和硼原子都采取sp2杂化分析;
(4)有1个O连着一个B,剩余的两个O分别连着2个B,说明有一个O完全属于B,剩下的两个O,B只占有O的$\frac{1}{2}$;硼砂晶体中阴离子[B4O5(OH)4]2-中一半sp3杂化形成BO4四面体;另一种是sp2杂化形成BO3平面三角形结构;
(5)根据氯化钠的结构知,氧离子和相邻的镍离子之间的距离为 $\frac{1}{2}$a,距离最近的两个阳离子核间的距离是距离最近的氧离子和镍离子距离的 $\sqrt{2}$倍,根据图片知,每个氧化镍所占的面积=1.40×10-10m×1.40×10-10m×sin60°,每个氧化镍的质量=$\frac{74.7}{N{\;}_{A}}$g,每个氧化镍的质量乘以每平方米含有的氧化镍个数就是每平方米含有的氧化镍质量.
解答 解:(1)Cu原子失去1个电子生成Cu+,Cu+核外有28个电子,失去的电子数是其最外层电子数,根据构造原理知Cu+基态核外电子排布式1s22s22p63s23p63d10或[Ar]3d10 ,故答案为:1s22s22p63s23p63d10或[Ar]3d10 ;
(2)A.1个氮原子中含有7个电子,则1个N5分子中含有35个电子,N5+是由N5分子失去1个电子得到的,则1个N5+粒子中有34个电子,故A错误;
B.N5+离子中每个氮原子均满足8电子结构,每个N原子形成3个共用电子对,还剩一对未成键电子,所以N5+离子中存在五对未成键的电子对,故B错误;
C.N5+离子的结构为 ,则N5+阳离子中存在两个氮氮三键,故C正确;
,则N5+阳离子中存在两个氮氮三键,故C正确;
故选:C;
(3)①3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3,
A.由CH4变为CO2,碳原子杂化类型由sp3转化为sp,反应前后碳原子的轨道杂化类型已经改变,故A错误;
B.CH4分子中价层电子对=σ 键电子对+中心原子上的孤电子对=4+$\frac{1}{2}$×(4-4×1)=4,且不含孤电子对,所以其空间构型是正四面体,H2O中价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,且含有2个孤电子对,所以H2O的VSEPR模型为四面体,分子空间构型为V型,、CO2分子中价层电子对=σ 键电子对+中心原子上的孤电子对=2+$\frac{1}{2}$×(4-2×2)=2,所以二氧化碳是直线型结构,故B正确;
C.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,这几种元素都是第二周期元素,它们的族序数分别是:第IIIA族、第IVA族、第VA族、第VIA族,所以它们的第一电离能大小顺序是I1(N)>I1(O)>I1(C)>I1(B),故C正确;
D.B一般是形成3个键,(H3BNH3)由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得,其中1个键是配位键,故D正确;
故答案为:A;
②1个(HB=NH)3分子中硼原子与氮原子间以σ键结合,而剩余的p轨道形成一个共轭大π键.B-H键有3个,N-H键有3个,B-N有σ键有6个,故一共12个;
故答案为:12;
(4)图(a)是一种链状结构的多硼酸根,从图可看出,每个BO32-单元,都有一个B,有一个O完全属于这个单元,剩余的2个O分别为2个BO32-单元共用,所以B:O=1:(1+2×$\frac{1}{2}$)=1:2,化学式为:[BO2]nn-(或BO2-),从图(b)是硼砂晶体中阴离子的环状结构可看出,[B4O5(OH)4]2-一半sp3杂化形成两个四配位BO4四面体;另一半是sp2杂化形成两个三配位BO3平面三角形结构,
故答案为:[BO2]nn-(或BO2-);sp2、sp3.
(5)根据氯化钠的结构知,氧离子和相邻的镍离子之间的距离为 $\frac{1}{2}$a,距离最近的两个阳离子核间的距离是距离最近的氧离子和镍离子距离的 $\sqrt{2}$倍,所以其距离是 $\frac{\sqrt{2}}{2}$acm;
根据图片知,每个氧化镍所占的面积=$\frac{4×1.40×10{\;}^{-10}m×8×1.40×10{\;}^{-10}m×sin60°}{8}$,则每平方米含有的氧化镍个数=$\frac{1}{4×1.4×10{\;}^{-10}×1.4×10{\;}^{-10}Sin60°}$,每个氧化镍的质量=$\frac{74.7}{N{\;}_{A}}$g,所以每平方米含有的氧化镍质量=$\frac{74.7}{N{\;}_{A}}$g×$\frac{1}{4×1.4×10{\;}^{-10}×1.4×10{\;}^{-10}Sin60°}$=1.83×10-3,
故答案为:$\frac{\sqrt{2}}{2}$a;1.83×10-3.
点评 本题考查学生对物质结构与性质模块的掌握情况,重点考查结构知识,涉及电离能、电子排布式、原子半径、空间结构、杂化轨道、化学式、晶体的计算等,考查知识全面、覆盖广,难度适中,可以衡量学生对该模块主干知识的掌握情况.

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
| A. | 分子的正、负电荷重心重合 | B. | 分子正、负电荷重心不重合 | ||
| C. | H2O2是极性分子 | D. | H2O2是非极性分子 |
| A. | SO2 | B. | H2 | C. | NH3 | D. | CO2 |
| A. | 11.2 LO2和O3组成的混合气体含有原子数为NA | |
| B. | 常温常压下,1.7 g NH3含有的电子数目为 NA | |
| C. | 0.1mol/LNa2SO4溶液中含有Na+的个数为0.2NA | |
| D. | 标准状况下,22.4 L NO2与足量的H2O充分反应后转移电子数为 NA |
②请按顺序排列出1mol/L (NH4)2SO4溶液中各种离子浓度大小关系c(NH4+)>c(SO42-)>c(H+)>c(OH-).
③25℃时,如果取0.2mol/LHA溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=10.混合溶液中由水电离出的c(H+)>0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
(2)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.8 kJ•mol-1
(3)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
②该反应为吸热反应(选填吸热、放热).
③能判断该反应是否达到化学平衡状态的依据是BC.
(A)容器中压强不变
(B)混合气体中[CO]不变
(C)v正(H2)=v逆(H2O)
(D)C(CO2)=C(CO)
| A. | KCl | B. | Na2S | C. | Na2O | D. | K2S |

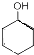 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$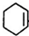 +H2O,反应类型为消去反应
+H2O,反应类型为消去反应 ,反应类型为缩聚反应
,反应类型为缩聚反应 ,T的分子式为C2H4O
,T的分子式为C2H4O .
. 实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定氢氧化钠的质量分数约为82%,为了验证其纯度,用浓度为0.2mol•L-1的盐酸进行滴定,完成下列问题:
实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定氢氧化钠的质量分数约为82%,为了验证其纯度,用浓度为0.2mol•L-1的盐酸进行滴定,完成下列问题: