题目内容
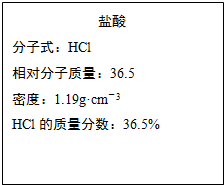 如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:
如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为______ mol/L.若用KMnO4氧化上述 HCl.其反应方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)该反应中的氧化剂是______.
(3)表现还原性的HCl与表现酸性的HCl的质量之比是______
(4)1mol KMnO4完全反应,被氧化的HCl的物质的量为______mol.
(5)8mol HCl完全反应,产生的Cl2在标准状况下的体积为______升.
解:(1)C=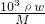 =
= =11.9mol/L,故答案为:11.9;
=11.9mol/L,故答案为:11.9;
(2)该反应中锰元素的化合价由+7价得电子变为+2价,所以高锰酸钾作氧化剂,故答案为:KMnO4;
(3)反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,根据原子守恒知,化合价变化的氯化氢的计量数是10,化合价不变的氯化氢的计量数是6,所以表现还原性的HCl与表现酸性的HCl的质量之比是10:6=5:3,故答案为:5:3;
(4)设被氧化的氯化氢的物质的量是x.
2KMnO4+10 HCl(浓)(作还原剂)+6HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
2mol 10mol
1mol x
x=5mol
故答案为:5;
(5)设生成氯气的体积是y.
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
16mol 112L
8mol y
y=56L,
故答案为:56.
分析:(1)c=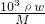 ;
;
(2)得电子化合价降低的反应物作氧化剂;
(3)该反应中失电子化合价升高的氯化氢作还原剂,化合价不变的氯化氢作酸;
(4)根据高锰酸钾与作还原剂的氯化氢的关系式计算;
(5)根据氯化氢和氯气之间的关系式计算.
点评:本题考查了氧化还原反应的有关计算、氧化剂的判断等知识点,难度不大,注意(5)题中,氯化氢是参加反应的氯化氢还是作还原剂的氯化氢,此处容易出错.
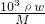 =
= =11.9mol/L,故答案为:11.9;
=11.9mol/L,故答案为:11.9;(2)该反应中锰元素的化合价由+7价得电子变为+2价,所以高锰酸钾作氧化剂,故答案为:KMnO4;
(3)反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,根据原子守恒知,化合价变化的氯化氢的计量数是10,化合价不变的氯化氢的计量数是6,所以表现还原性的HCl与表现酸性的HCl的质量之比是10:6=5:3,故答案为:5:3;
(4)设被氧化的氯化氢的物质的量是x.
2KMnO4+10 HCl(浓)(作还原剂)+6HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
2mol 10mol
1mol x
x=5mol
故答案为:5;
(5)设生成氯气的体积是y.
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
16mol 112L
8mol y
y=56L,
故答案为:56.
分析:(1)c=
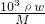 ;
;(2)得电子化合价降低的反应物作氧化剂;
(3)该反应中失电子化合价升高的氯化氢作还原剂,化合价不变的氯化氢作酸;
(4)根据高锰酸钾与作还原剂的氯化氢的关系式计算;
(5)根据氯化氢和氯气之间的关系式计算.
点评:本题考查了氧化还原反应的有关计算、氧化剂的判断等知识点,难度不大,注意(5)题中,氯化氢是参加反应的氯化氢还是作还原剂的氯化氢,此处容易出错.

练习册系列答案
相关题目
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: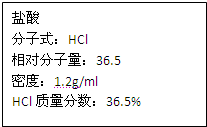 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: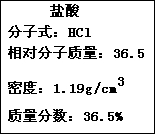
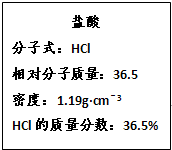 如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:
如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题: 如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题: