题目内容
 如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:(1)该浓盐酸中HCl的物质的量浓度为
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
1884年某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.400mol/L的稀盐酸;
①该学生需要量取
②如果实验室有10mL、20mL、50mL量筒,应选用
③容量瓶上除有刻度线外还应标有
④将量取的浓盐酸加入
⑤定容时的操作是:
⑥配制过程中,下列实验操作导致所配制的稀盐酸的物质的量浓度偏大的有
A.量取浓盐酸时发现量筒不干净,用水洗净后直接量取
B.用量筒量取浓盐酸时仰视观察凹液面
C.配制时,容量瓶未干燥有少量蒸馏水
D.定容时俯视刻度线
E.加蒸馏水时不慎超过了刻度线,用胶体滴管吸出
F.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水.
分析:(1)根据c=
计算出浓盐酸的物质的量浓度;
(2)根据各量的计算公式是否与体积有关判断;
(3)①根据稀释前后溶质的物质的量不变计算浓溶液的体积;
②量取16.8mL浓盐酸,需要使用20mL量筒;
③根据容量瓶的构造分析;
④稀释浓盐酸应该在烧杯中进行;
⑤根据配制一定物质的量浓度的溶液正确定容方法解答;
⑥根据c=
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化,若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.
| 1000ρw |
| M |
(2)根据各量的计算公式是否与体积有关判断;
(3)①根据稀释前后溶质的物质的量不变计算浓溶液的体积;
②量取16.8mL浓盐酸,需要使用20mL量筒;
③根据容量瓶的构造分析;
④稀释浓盐酸应该在烧杯中进行;
⑤根据配制一定物质的量浓度的溶液正确定容方法解答;
⑥根据c=
| n |
| V |
解答:解:(1)该浓盐酸的物质的量浓度为:
=11.9mol/L,
故答案为:11.9;
(2)任何溶液都是均一稳定的分散系,任何体积的密度和浓度不变,而体积不同时,溶质的物质的量不同,溶液中离子的数目也不同,
故选BD;
(3)①配制480mL溶液,实验室没有480mL容量瓶,应该配制500mL 0.400mol/L的溶液,
根据溶液稀释前后溶质的物质的量不变得c1V1=c2V2,V1=
=0.0168L=16.8mL,
故答案为:16.8;
②配制溶液需要量取16.8mL浓盐酸,为了减小误差,应该选用20mL量筒,
故答案为:20;
③容量瓶是一种在常温下配制一定浓度的溶液的定量仪器,容量瓶上标有刻度线、容积和温度,
故答案为:温度(或20℃)和容积
④量取的浓盐酸应该在烧杯中进行稀释,不能在容量瓶中稀释,
故答案为:烧杯
⑤稀释、洗涤转移溶液后,对溶液进行定容,方法为:向容量瓶中加入蒸馏水,在距离刻线1~2cm时,改用胶头滴管滴加蒸馏水,至凹液面最低处与刻线相切,
故答案为:向容量瓶中加入蒸馏水,在距离刻线1~2cm时,改用胶头滴管滴加蒸馏水,至凹液面最低处与刻线相切;
⑥A.量取浓盐酸时发现量筒不干净,用水洗净后直接量取,导致浓盐酸的浓度减小,量取的浓盐酸中氯化氢的物质的量减小,根据c=
可得,配制的溶液浓度偏低,故A错误;
B.用量筒量取浓盐酸时仰视观察凹液面,导致量取的浓盐酸体积偏大,配制的溶液中溶质氯化氢物质的量偏大,根据c=
可得,溶液浓度偏大,故B正确;
C.配制时,容量瓶未干燥有少量蒸馏水,对溶液体积和溶质的物质的量都没有影响,所以不影响配制结果,故C错误;
D.定容时俯视刻度线,导致加入的蒸馏水体积偏小,根据c=
可得,配制的溶液浓度偏大,故D正确;
E.加蒸馏水时不慎超过了刻度线,用胶体滴管吸出,导致配制的溶液体积偏大,根据c=
可得,溶液浓度偏低,故E错误;
F.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,导致配制的溶液体积偏大,根据c=
可得,配制的溶液浓度偏低,故F错误;
故选BD.
| 1000×1.19×36.5% |
| 36.5 |
故答案为:11.9;
(2)任何溶液都是均一稳定的分散系,任何体积的密度和浓度不变,而体积不同时,溶质的物质的量不同,溶液中离子的数目也不同,
故选BD;
(3)①配制480mL溶液,实验室没有480mL容量瓶,应该配制500mL 0.400mol/L的溶液,
根据溶液稀释前后溶质的物质的量不变得c1V1=c2V2,V1=
| 0.400mol/L×0.5L |
| 11.9mol/L |
故答案为:16.8;
②配制溶液需要量取16.8mL浓盐酸,为了减小误差,应该选用20mL量筒,
故答案为:20;
③容量瓶是一种在常温下配制一定浓度的溶液的定量仪器,容量瓶上标有刻度线、容积和温度,
故答案为:温度(或20℃)和容积
④量取的浓盐酸应该在烧杯中进行稀释,不能在容量瓶中稀释,
故答案为:烧杯
⑤稀释、洗涤转移溶液后,对溶液进行定容,方法为:向容量瓶中加入蒸馏水,在距离刻线1~2cm时,改用胶头滴管滴加蒸馏水,至凹液面最低处与刻线相切,
故答案为:向容量瓶中加入蒸馏水,在距离刻线1~2cm时,改用胶头滴管滴加蒸馏水,至凹液面最低处与刻线相切;
⑥A.量取浓盐酸时发现量筒不干净,用水洗净后直接量取,导致浓盐酸的浓度减小,量取的浓盐酸中氯化氢的物质的量减小,根据c=
| n |
| V |
B.用量筒量取浓盐酸时仰视观察凹液面,导致量取的浓盐酸体积偏大,配制的溶液中溶质氯化氢物质的量偏大,根据c=
| n |
| V |
C.配制时,容量瓶未干燥有少量蒸馏水,对溶液体积和溶质的物质的量都没有影响,所以不影响配制结果,故C错误;
D.定容时俯视刻度线,导致加入的蒸馏水体积偏小,根据c=
| n |
| V |
E.加蒸馏水时不慎超过了刻度线,用胶体滴管吸出,导致配制的溶液体积偏大,根据c=
| n |
| V |
F.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,导致配制的溶液体积偏大,根据c=
| n |
| V |
故选BD.
点评:本题考查了配制一定物质的量浓度的溶液的方法,该题是中等难度的试题,试题基础性强,贴近高考;该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力;该题的难点在于误差分析,注意掌握误差分析的方法和技巧.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案
相关题目
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: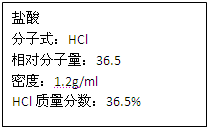 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
 如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:
如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题: