题目内容
如图为实验室某浓盐酸试剂瓶标签上的有关数据,根据有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为
(2)取用任意体积的该盐酸溶液时,下列物理量不随所取体积多少而变化的是
A.溶液中HCl的质量B.溶液的物质的量浓度
C.溶液中H+的数目D.溶液的密度
(3)欲配制上述浓盐酸,需要在1L水中通入标态下
(4)现有1L1mol/L的稀盐酸,欲使其浓度增大1倍,采取的措施合理的是
A.通入标况下HCl气体22.4LB.将溶液加热浓缩至0.5L
C.加入5mol/L的盐酸0.6L,再稀释至2LD.加入1L 3mol/L的盐酸混合均匀.

(1)该浓盐酸中HCl的物质的量浓度为
11.9
11.9
mol/L(2)取用任意体积的该盐酸溶液时,下列物理量不随所取体积多少而变化的是
BD
BD
A.溶液中HCl的质量B.溶液的物质的量浓度
C.溶液中H+的数目D.溶液的密度
(3)欲配制上述浓盐酸,需要在1L水中通入标态下
352.8
352.8
L HCl气体(保留1位小数)(4)现有1L1mol/L的稀盐酸,欲使其浓度增大1倍,采取的措施合理的是
C
C
A.通入标况下HCl气体22.4LB.将溶液加热浓缩至0.5L
C.加入5mol/L的盐酸0.6L,再稀释至2LD.加入1L 3mol/L的盐酸混合均匀.
分析:(1)根据c=
计算该盐酸的物质的量浓度;
(2)根据溶液为均一稳定化合物的特征分析;
(3)根据n=
结合溶液的质量分数计算;
(4)根据c=
计算.
| 1000ρw |
| M |
(2)根据溶液为均一稳定化合物的特征分析;
(3)根据n=
| V |
| Vm |
(4)根据c=
| n |
| V |
解答:解:(1)c=
=
=11.9mol/L,故答案为:11.9;
(2)溶液为均一稳定化合物,取用任意体积的该盐酸溶液时,溶液的浓度和密度不变,而体积不同,则溶液的质量和物质的量不同,故答案为:BD;
(3)溶液的质量分数为36.5%,则63.5g水中溶解36.5gHCl,
1L水的质量为1000g,需溶解HCl的质量为:
×36.5g=574.8g,
n(HCl)=
=15.75mol,
V(HCl)=15.75mol×22.4L/mol=352.8L,
故答案为:352.8;
(4)A.通入标况下HCl气体22.4L,溶质的物质的量为2mol,但溶液的密度变化,溶液的体积变化,故浓度不等于原溶液2倍,故A错误;
B.将溶液加热浓缩至0.5L,水挥发的同时盐酸挥发,溶液浓度不等于原溶液2倍,故B错误;
C.加入5mol/L的盐酸0.6L,再稀释至2L时,c=
=2moL/L,故C正确;
D.加入1L 3mol/L的盐酸混合均匀,溶液密度变化,体积不等于原溶液体积2倍,故浓度不等于原溶液2倍,故D错误.
故答案为:C.
| 1000ρw |
| M |
| 1000×1.19g/L×36.5% |
| 36.5g/mol |
(2)溶液为均一稳定化合物,取用任意体积的该盐酸溶液时,溶液的浓度和密度不变,而体积不同,则溶液的质量和物质的量不同,故答案为:BD;
(3)溶液的质量分数为36.5%,则63.5g水中溶解36.5gHCl,
1L水的质量为1000g,需溶解HCl的质量为:
| 1000g |
| 63.5g |
n(HCl)=
| 574.8g |
| 36.5g/mol |
V(HCl)=15.75mol×22.4L/mol=352.8L,
故答案为:352.8;
(4)A.通入标况下HCl气体22.4L,溶质的物质的量为2mol,但溶液的密度变化,溶液的体积变化,故浓度不等于原溶液2倍,故A错误;
B.将溶液加热浓缩至0.5L,水挥发的同时盐酸挥发,溶液浓度不等于原溶液2倍,故B错误;
C.加入5mol/L的盐酸0.6L,再稀释至2L时,c=
| 1L×1mol/L+0.6L×5mol/L |
| 2L |
D.加入1L 3mol/L的盐酸混合均匀,溶液密度变化,体积不等于原溶液体积2倍,故浓度不等于原溶液2倍,故D错误.
故答案为:C.
点评:本题从多个角度考查溶液的浓度的计算及混合、稀释等问题,题目难度中等,注意把握相关计算公式的运用.

练习册系列答案
相关题目
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: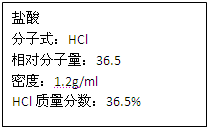 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: 如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:
如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题: 如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题: