题目内容
19.常温常压下,某气态烃和氧气的混合气体20L,完全燃烧后通过浓硫酸后,再恢复到原来条件,气体体积变为原来的一半.设烃完全燃烧无剩余,则该烃可能是( )①CH4 ②C2H4 ③C2H2 ④C2H6 ⑤C3H6 ⑥C3H4 ⑦C3H8 ⑧C4H6.
| A. | 只有①③④ | B. | ⑤⑥⑦⑧ | C. | 只有②⑦ | D. | ①②④⑦ |
分析 设烃的化学式为CxHy,烃燃烧方程式为CxHy+(x+y4)O2点燃_xCO2+y2H2O,浓硫酸吸收水蒸气,恢复到原来条件,反应前后气体体积减少一半,相同条件下气体的体积之比等于其物质的量之比,即(1+x+y4-x)=12(1+x+y4),y=4(x-1),常温常压下是气态,则x≤4,据此分析解答.
解答 解:设烃的化学式为CxHy,烃燃烧方程式为CxHy+(x+y4)O2点燃_xCO2+y2H2O,浓硫酸吸收水蒸气,恢复到原来条件,反应前后气体体积减少一半,相同条件下气体的体积之比等于其物质的量之比,即(1+x+y4-x)=12(1+x+y4),y=4(x-1),常温常压下是气态,则x≤4,
如果x=1,则y=0,没有这种烃;
如果x=2,y=4,为乙烯;
如果x=3,y=8,为丙烷;
如果x=4,y=13,没有这种烃,
故选C.
点评 本题考查化学方程式的有关计算,明确反应前后气体减少的量是解本题关键,结合方程式分析解答,题目难度不大.

练习册系列答案
相关题目
10.下列反应中反应类型不相同的是( )
| A. | 乙烯与水反应生成乙醇,乙炔与氢气反应 | |
| B. | 光照下,丙烷与氯气的反应;丙炔与溴的四氯化碳溶液反应 | |
| C. | 丙烯与酸性高锰酸钾溶液反应;丁烷燃烧 | |
| D. | 乙烯生成聚乙烯,乙炔生成聚乙炔 |
7.一辆运送化学物品的槽罐车侧翻,罐内15t苯泄入路边的水渠,下列叙述有科学性错误的是( )
| A. | 如果大量苯溶入水中渗入土壤,会对周边农田、水源造成严重污染 | |
| B. | 可以采取抽吸水渠中上层液体的办法,达到部分清除泄漏物的目的 | |
| C. | 由于苯是一种易挥发、易燃的物质,周围地区如果有一个火星就可能引起爆炸 | |
| D. | 事故发生地周围比较空旷,有人提议用点火焚烧的办法来清除泄漏物,会产生大量浓烟,所以该方法未被采纳 |
4.提纯下列物质(括号内少量杂质),所选用的除杂质试剂与分离方法正确的是( )
| 不纯物质 | 处杂试剂 | 分离方法 | |
| A | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙醇(水) | 新制生石灰 | 蒸馏 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
11.A、B、C、D、E是中学化学中五种常见元素,有关信息如下:
请回答下列问题:
(1)A的氢化物分子的电子式是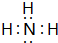 ,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+
,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+
(2)B、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为离子键、共价键
(3)A、D的氢化物相互反应,产生白色固体NH4Cl(填化学式),对该固体中阳离子存在检验的操作方法及现象是:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生),证明存在该阳离子.
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)A的氢化物分子的电子式是
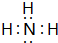 ,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+
,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+(2)B、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为离子键、共价键
(3)A、D的氢化物相互反应,产生白色固体NH4Cl(填化学式),对该固体中阳离子存在检验的操作方法及现象是:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生),证明存在该阳离子.
8.下列变化中,不需要破坏化学键的是( )
| A. | 干冰气化 | B. | 加热氯化铵 | C. | 食盐熔化 | D. | 氯化氢溶于水 |
16.在恒温恒容的密闭容器中发生反应:Fe3O4(s)+4H2(g)?3Fe(s)+4H2O(g).下列说法不正确的是( )
| A. | 该反应的平衡常数表达式:K=c4(H2O)c4(H2) | |
| B. | 若容器内气体的压强保持不变,说明该反应已达到平衡状态 | |
| C. | 若Fe3O4足量,改变起始充入H2的浓度,达平衡时H2的转化率不变 | |
| D. | 经2min后,H2浓度下降了0.1mol.L-1则反应速度为v(H2O)=0.05mol.L-1.min-1. |