题目内容
3.下列关于元素周期律的叙述正确的是( )| A. | 随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现 | |
| B. | 元素的性质随着原子序数的递增而呈周期性变化 | |
| C. | 随着元素原子序数的递增,元素的最高正价从+1到+7,负价从-7到-1重复出现 | |
| D. | 主族元素原子的最高正价和负价的绝对值之和一定是8 |
分析 A.在第一周期,随着元素原子序数的递增,原子最外层电子数总是从1到2;
B.元素的性质与原子结构、原子序数有着递变规律;
C.元素的最低负价是-4价,最高正价是+7价;
D.氢元素的最高正价和负价的绝对值之和为2.
解答 解:A.从第二周期开始,随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现,而在第一周期,随着元素原子序数的递增,原子最外层电子数总是从1到2,故A错误;
B.元素的性质随原子核外电子排布的周期性变化而变化,则元素的性质随着核电荷数的递增而呈周期性变化,故B正确;
C.元素的最低负价是-4价,最高正价是+7价,随着元素原子序数的递增,一般情况下元素的最高正价从+1到+7,负价从-4到-1重复出现,故C错误;
D.氢元素的最高正价和负价的绝对值之和为2,氟元素等没有正化合价,故D错误;
关系B.
点评 本题考查元素周期表和元素周期律知识,为高考常见题型,题目难度中等,试题侧重于基础知识的考查,能很好地培养学生的良好的科学素养,注意相关基础知识的积累.

练习册系列答案
相关题目
13.下列关于乙炔制取的说法不正确的是( )
| A. | 为了减慢反应速率可用饱和食盐水代替水反应 | |
| B. | 此反应是放热反应 | |
| C. | 为了除去杂质气体,可用硫酸铜溶液 | |
| D. | 反应中需加碎瓷片作沸石 |
11.A、B、C、D、E是中学化学中五种常见元素,有关信息如下:
请回答下列问题:
(1)A的氢化物分子的电子式是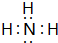 ,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+
,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+
(2)B、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为离子键、共价键
(3)A、D的氢化物相互反应,产生白色固体NH4Cl(填化学式),对该固体中阳离子存在检验的操作方法及现象是:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生),证明存在该阳离子.
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)A的氢化物分子的电子式是
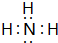 ,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+
,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+(2)B、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为离子键、共价键
(3)A、D的氢化物相互反应,产生白色固体NH4Cl(填化学式),对该固体中阳离子存在检验的操作方法及现象是:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生),证明存在该阳离子.
8.下列变化中,不需要破坏化学键的是( )
| A. | 干冰气化 | B. | 加热氯化铵 | C. | 食盐熔化 | D. | 氯化氢溶于水 |
20.下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是( )
| A. | CH3CH2CH2CH3 | B. |  | C. | CH3CH2CH3 | D. |  |





 .
.