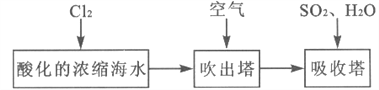
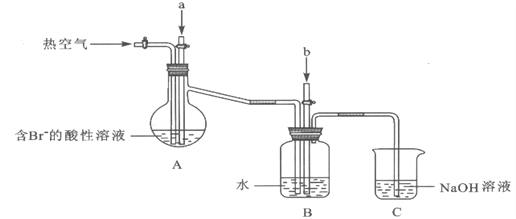
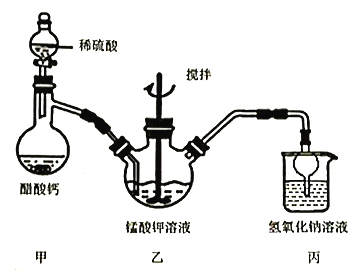
题目内容
【题目】下列有关实验装置、操作,不能实现相应实验目的的是
A | B | C | D | |
装置 |
|
|
|
|
目的 | 用KOH溶液除去溴苯中单质溴 | 证明浓硫酸有脱水性、强氧化性 | 先出现白色沉淀,后出现砖红色沉淀,证明Ksp(AgCl)< Ksp(Ag2CrO4) | 不能通过观察水能否全部流下来判断装置气密性 |
A. A B. B C. C D. D
【答案】C
【解析】
A.溴和NaOH反应生成可溶性的钠盐,溴苯不易溶于水,然后采用分液方法分离提纯溴苯,所以A选项是正确的;
B.浓硫酸具有脱水性和强氧化性,能将蔗糖脱水碳化(有黑色物质生成)并放出大量的热,在此条件下,碳可以把浓硫酸还原为二氧化硫,二氧化硫能使品红溶液褪色,故该过程可以证明浓硫酸表现了脱水性和强氧化性,所以B选项是正确的;
C. Ag2CrO4和AgCl的组成结构不相似,,不能依据先生成白色沉淀就判断氯化银的Ksp较小,只能依此判断氯化银的溶解度较小,故C错误;
D.该装置中分液漏斗和烧瓶通过橡皮管连接,可以使两者中的气压相同,打开分液漏斗的活塞后,分液漏斗中的水可以顺利完全流下,故不能依此判断该装置的气密性如何,故D选项是正确的。
故选C。

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
相关题目