题目内容
【题目】已知:pOH=-lgc(OH-),温度为T℃时,向20.00mL 0.01mol·L-1氨水中滴入0.10mol·L-1的盐酸(不考虑溶质挥发),溶液的pH和pOH与加入盐酸体积关系如图所示。下列说法正确的是
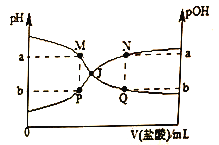
A. 曲线PJN表示溶液中pH的变化
B. 若M点水的电离程度与Q点相等,则Q点一定符合c(Cl-)>c(NH4+)+c(NH3·H2O)
C. M、P两点的数值之和a+b=14
D. pH与pOH交叉点J对应的V(盐酸)=20.00mL
【答案】B
【解析】
温度为T℃时,向20.00mL 0.01mol·L-1氨水中滴入0.10mol·L-1的盐酸,发生反应为:NH3![]() H2O+HCl═NH4Cl+ H2O ,化学计量点时,恰好生成NH4Cl,NH4Cl水解使溶液显酸性,结合图象分析。
H2O+HCl═NH4Cl+ H2O ,化学计量点时,恰好生成NH4Cl,NH4Cl水解使溶液显酸性,结合图象分析。
温度为T℃时,向20.00mL 0.01mol·L-1氨水中滴入0.10mol·L-1的盐酸,发生反应为:NH3![]() H2O+HCl═NH4Cl+ H2O ,化学计量点时,恰好生成NH4Cl,NH4Cl水解使溶液显酸性。
H2O+HCl═NH4Cl+ H2O ,化学计量点时,恰好生成NH4Cl,NH4Cl水解使溶液显酸性。
A.酸滴入碱中,溶液的pH逐渐减小,pOH逐渐增大,故曲线PJN为pOH变化曲线,而曲线MJQ则为pH变化曲线,故A错误;
B. 酸或碱抑制水电离,含有弱离子的盐促进水电离,J点为中性溶液,则M点中pH>pOH,溶液呈碱性,Q点pH<pOH,溶液呈酸性,若M点水的电离程度与Q点相等,则Q点不可能是NH4Cl溶液[若为NH4Cl溶液存在物料守恒关系c(Cl-)=c(NH4+)+c(NH3·H2O)],应为NH4Cl和HCl混合溶液,则Q点一定符合c(Cl-)>c(NH4+)+c(NH3·H2O),故B正确;
C. 常温时,水的离子积Kw=1.0×10-14,M、P两点为滴定过程中相同时刻同一溶液的pH与pOH,故a+b=pH+pOH=-lgKw=14,即M、P两点的数值之和a+b=14,但温度若不是常温,Kw不同,a+b![]() 14,故C错误;
14,故C错误;
D. J点pH=pOH,c(H+)=c(OH-),溶液呈中性,故氨水过量,即J点表示V(盐酸) <20.00mL,故D错误。
故选B。

【题目】甲醇是重要的化工原料,利用煤化工中生产的CO、CO2和H2可制取甲醇等有机物,发生的反应有:
①CO(g)+2H2(g)![]() CH3OH(g) △H1=-99kJ·mol-1
CH3OH(g) △H1=-99kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
相关物质的化学键键能数据如下:
化学键 | C=O(CO2) | H—H | C—O | H—O | C—H |
E/(kJ·mol-1) | 803 | 436 | 343 | 465 | 413 |
(1)该反应△H2=___________。
(2)关于反应①下列说法,正确的是___________。
A.该反应在任何温度下都能自发进行
B.升高温度,正反应速率增大,逆反应速率减小
C.使用催化剂,不能提高CO的转化率
D.增大压强,该反应的化学平衡常数不变
(3)在某温度下,将1.0moCO与2.0molH2充入2L的空钢瓶中,发生反应①,在第5min时达到化学平衡状态,此时甲醇的物质的量分数为0.1。在第10min、20min时分别改变反应条件,甲醇的浓度在不同条件下的变化状况如下图所示:

①从反应开始到5min时,生成甲醇的平均速率为___________。
②H2的平衡转化率α=___________%,化学平衡常数K=___________。
③1min时,υ正___________υ逆(填“大于”“小于”或“等于”)
④1mim时υ正___________4min时υ逆(填“大于”“小于”或“等于”)
⑤比较甲醇在7~8min、12~13min和25~27min时平均反应速率[平均反应速率分别以υ(7~8)、υ(12~13)、υ(25~27)表示的大小_________________________________。
③若将钢瓶换成同容积的绝热容器,重复上述试验,平衡时甲醇的物质的量分数___________0.1。(填“>”、“<”或“=”)
【题目】(1)甲烷重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
反应过程 | 化学方程式 | 焓变ΔH(kJ·mol-1) |
甲烷 氧化 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | ΔH1 |
CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | |
蒸汽 重整 | CH4(g)+H2O(g)=CO(g)+3H2(g) | +206.2 |
CH4(g)+2H2O(g)=CO2(g)+4H2(g) | +165.0 |
①反应CO(g)+H2O(g)=CO2(g)+H2(g)的ΔH=________kJ·mol-1。
②甲烷的燃烧热为ΔH2,则ΔH2________ΔH1(填“>”“=”或“<”)。
(2)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气合成为甲醇,甲醇是汽车燃料电池的重要燃料。已知氢气、甲醇燃烧的热化学方程式:
2H2(g)+O2(g)=2H2O(l) ΔH=-570 kJ·mol-1 ①
CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-726.0 kJ·mol-1 ②
O2(g)=CO2(g)+2H2O(l) ΔH=-726.0 kJ·mol-1 ②
写出二氧化碳与氢气合成甲醇液体的热化学方程式:___________。
(3)有科技工作者利用稀土金属氧化物作为固体电解质制造出了甲醇空气燃料电池。这种稀土金属氧化物在高温下能传导O2-。
①这个电池的正极发生的反应是_______;负极发生的反应是________。
②在稀土氧化物的固体电解质中,O2-的移动方向是________。
【题目】下列有关实验装置、操作,不能实现相应实验目的的是
A | B | C | D | |
装置 |
|
|
|
|
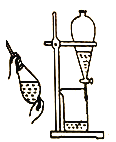
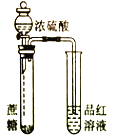
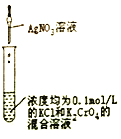
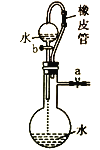
目的 | 用KOH溶液除去溴苯中单质溴 | 证明浓硫酸有脱水性、强氧化性 | 先出现白色沉淀,后出现砖红色沉淀,证明Ksp(AgCl)< Ksp(Ag2CrO4) | 不能通过观察水能否全部流下来判断装置气密性 |
A. A B. B C. C D. D