题目内容
【题目】工业以浓缩海水为原料提取溴的部分过程如下:
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):
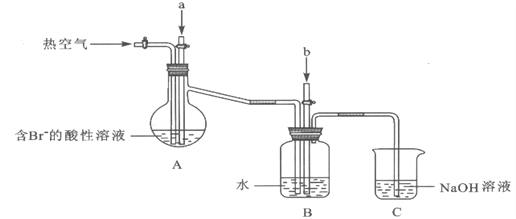
(1)实验开始时,A装置中不通热空气,先通入a气体的目的是(用离子方程式表示)_________。
(2)A装置中通入a气体一段时间后,停止通入,改通热空气。通入热空气的目的是_________。
(3)反应过程中,B装置中Br2与SO2反应的化学方程式____________________。
(4)C装置的作用是___________________。
(5)该小组同学向反应后B装置的溶液中通入氯气,充分反应得到混合液。
①一位同学根据溴的沸点是59℃,提出采用____________________方法从该混合液中分离出溴单质。
②另一位同学向该混合液中加入四氯化碳,充分振荡、静置后放出下层液体,这种方法是________。
(6)某同学提出证明反应后B装置的溶液中含有溴离子的实验方案是:取出少量溶液,先加入过量新制氯水,再加入KI淀粉溶液,观察溶液是否变蓝色。该方案是否合理并简述理由: _______。
【答案】 Cl2+2Br-=2 Cl-+Br2 将溴从蒸馏烧瓶A中吹出 SO2+2 H2O+Br2=H2SO4+2 HBr 吸收未反应完的Cl2、Br2、SO2等有毒气体,防止污染空气 蒸馏 萃取分液 不合理,氯水可能过量
【解析】(1)要想使溴离子变成溴单质,则加入的a能和溴离子发生反应生成溴单质,氯气能和溴离子发生置换反应生成溴单质,离子反应方程式为Cl2+2Br-=2Cl-+Br2,故答案为:Cl2+2Br-=2Cl-+Br2;
(2)溴易挥发,升高温度促进其挥发,所以通入热空气的目的是吹出Br2,故答案为:将溴从蒸馏烧瓶A中吹出;
(3)使溴蒸气转化为氢溴酸以达到富集的目的,可知气体b为SO2,发生的反应为Br2+SO2+2H2O=2HBr+H2SO4,故答案为:Br2+SO2+2H2O=2HBr+H2SO4;
(4)氯气不可能完全反应,氯气和溴离子反应生成溴单质,未反应的二氧化硫、氯气和溴都有毒,不能直接排空,且这几种物质都能和碱反应,所以C装置是尾气处理装置,可知C的作用为吸收未反应的Cl2、Br2和SO2,故答案为:吸收未反应的Cl2、Br2和SO2,防止污染空气;
(5)①根据溴的沸点是59℃,水溶液的沸点相差较大,可以采用蒸馏方法从该混合液中分离出溴单质,故答案为:蒸馏;
②溴易溶于四氯化碳,向混合液中加入四氯化碳,充分振荡、静置后放出下层液体,这种方法叫萃取和分液,故答案为:萃取分液;
(6)过量的氯水也能够将碘化钾氧化生成碘单质,导致溶液变蓝,不能证明溶液中含有溴离子,故答案为:不合理;过量氯水也能氧化碘化钾。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案【题目】体操运动员在完成单杠、吊环项目时常用“镁粉”搓手,以起到防滑效果。某种“镁粉”中可能含有Mg、MgO、Mg(OH)2、MgCO3中的一种或两种固体,实验小组对其成分展开了探究。
已知:MgO+2HCl=MgCl2+H2O MgCO3+2HCl=MgCl2+H2O+CO2↑
(1)探究“镁粉”中是否含有Mg和MgCO3
①取少量样品,如图所示进行实验。观察到a试管中有气泡产生,b试管中产生的现象是澄清石灰水变浑浊,则证明“镁粉”中一定含有______。
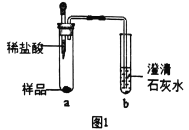
②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭。但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成浓NaOH溶液,目的是______________。小明按照修改后的实验方案重复上述实验,观察到b试管中无明显现象,证明“镁粉”中______________。
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验。分别取0.5g三种固体粉末,每次取样方法如图2所示:
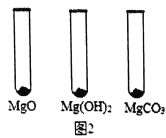
逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失。在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
MgO | Mg(OH)2 | MgCO3 | |
消耗稀盐酸的体积 /mL | 10.4 | 7.2 | 5.0 |
Mg(OH)2与盐酸发生中和反应的化学方程式为_____________。
Ⅱ.取“镁粉”样品0.5 g,加入上述稀盐酸至粉末恰好溶解。此时消耗稀盐酸的体积约为5.3 mL。
【实验分析及结论】
“镁粉”不只含有MgCO3。理由是____________________________________。
【实验反思】
为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5 g“镁粉”和0.5 g_________,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL。由此可知“镁粉”中含有MgCO3的质量分数为___________。
【题目】(1)甲烷重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
反应过程 | 化学方程式 | 焓变ΔH(kJ·mol-1) |
甲烷 氧化 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | ΔH1 |
CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | |
蒸汽 重整 | CH4(g)+H2O(g)=CO(g)+3H2(g) | +206.2 |
CH4(g)+2H2O(g)=CO2(g)+4H2(g) | +165.0 |
①反应CO(g)+H2O(g)=CO2(g)+H2(g)的ΔH=________kJ·mol-1。
②甲烷的燃烧热为ΔH2,则ΔH2________ΔH1(填“>”“=”或“<”)。
(2)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气合成为甲醇,甲醇是汽车燃料电池的重要燃料。已知氢气、甲醇燃烧的热化学方程式:
2H2(g)+O2(g)=2H2O(l) ΔH=-570 kJ·mol-1 ①
CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-726.0 kJ·mol-1 ②
O2(g)=CO2(g)+2H2O(l) ΔH=-726.0 kJ·mol-1 ②
写出二氧化碳与氢气合成甲醇液体的热化学方程式:___________。
(3)有科技工作者利用稀土金属氧化物作为固体电解质制造出了甲醇空气燃料电池。这种稀土金属氧化物在高温下能传导O2-。
①这个电池的正极发生的反应是_______;负极发生的反应是________。
②在稀土氧化物的固体电解质中,O2-的移动方向是________。
【题目】化学兴趣A组的同学们利用废硫酸溶液制备K2SO4晶体,设计流程如下图所示:

(1)写出反应Ⅰ的化学方程式:______________________。
(2)反应Ⅱ生成了一种可用作肥料的物质M,M的化学式为_________________。
(3)上述流程中可循环使用的物质有CO2和_________(填化学式)。
(4)反应Ⅲ中相关物质在25℃时的溶解度如下表。
物质 |
|
|
|
|
溶解度/g | 34.0 | 11.1 | 37.2 | 19.5 |
反应Ⅲ在常温下(25℃)能实现的原因是_________________________。
(5)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的原因是_____________;为了检验此晶体是否洗涤干净,取最后一次洗涤液于试管中,先加入过量的_______(选填字母),振荡、静置, 再向上层清液中滴加_______(选填字母),观察现象即可判断该晶体是否洗涤干净。
A. AgNO3溶液 B. BaCl2溶液 C. Ba(NO3)2溶液 D .Ba(OH)2溶液 E. NaOH溶液
【题目】下列有关实验装置、操作,不能实现相应实验目的的是
A | B | C | D | |
装置 |
|
|
|
|
目的 | 用KOH溶液除去溴苯中单质溴 | 证明浓硫酸有脱水性、强氧化性 | 先出现白色沉淀,后出现砖红色沉淀,证明Ksp(AgCl)< Ksp(Ag2CrO4) | 不能通过观察水能否全部流下来判断装置气密性 |
A. A B. B C. C D. D





