题目内容
【题目】三氯甲醛(CCl3CHO)可用于生产氯霉素、合霉素等,其在实验室制备的反应原理为C2H5OH+4C12![]() CCl3CHO+5HCl,可能发生的副反应是C2H50H+ HCl
CCl3CHO+5HCl,可能发生的副反应是C2H50H+ HCl ![]() C2H5Cl+ H2O。某探究小组在实验室模拟制备三氯乙醛的装置如图所示(夹持、加热装置均略去)。回答下列问题:
C2H5Cl+ H2O。某探究小组在实验室模拟制备三氯乙醛的装置如图所示(夹持、加热装置均略去)。回答下列问题:
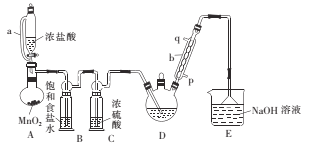
(1)仪器a的名称是____ ,采用该仪器的理由是____
(2)仪器b中冷凝水从___ (填“p”或“q”)口进。
(3)装置A中MnO2用KClO3代替,反应在常温下进行,试写出反应的离子方程式:____。若撤去装置B,对实验的影响是_______ 。
(4)测定产品纯度:
①称取0. 40 g产品,配成待测溶液,加入20. 00 mL0.100 mol/L碘标准溶液,再加适量碱液,充分反应:![]()
②再加适量盐酸调节溶液的pH,并立即用0.020 mol/L的Na2S2O3溶液滴定到终点,发生反应:I2+![]() ;
;
③重复上述操作3次,平均消耗Na2S2O3溶液20. 00 mL。
滴定时所用指示剂是____,达到滴定终点的现象是 ___,测得产品的纯度是____(保留三位有效数字)。
【答案】恒压分液漏斗 平衡漏斗上方和烧瓶内气体的压强,便于液体顺利滴下 p ClO3+6H++5Cl===3Cl2↑+3H2O 生成的氯气中混有的HCl气体会与乙醇反应生成氯乙烷,导致三氯乙醛的纯度降低 淀粉溶液 滴入最后一滴Na2S2O3溶液,锥形瓶中的颜色有蓝色变为无色,且半分钟内部恢复原色 66.4%
【解析】
A装置利用二氧化锰与浓盐酸制备氯气,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,B装置用饱和食盐水除去HCl,C装置盛放浓硫酸干燥氯气,D中反应制备CCl3CHO,E装置盛放氢氧化钠溶液,吸收尾气中过量的氯气等防止污染空气。
MnCl2+Cl2↑+2H2O,B装置用饱和食盐水除去HCl,C装置盛放浓硫酸干燥氯气,D中反应制备CCl3CHO,E装置盛放氢氧化钠溶液,吸收尾气中过量的氯气等防止污染空气。
(1)根据仪器a的结构特点可知其为恒压分液漏斗;恒压分液漏斗的导管可以平衡漏斗上方和烧瓶内气体的压强,便于液体顺利滴下;
(2)仪器b为球形冷凝管,为了更好的冷凝效果,冷凝水应从p口进入,q口流出;
(3)装置A为浓盐酸与二氧化锰共热制取氯气,用KClO3代替二氧化锰做氧化剂,发生归中反应,离子方程式为:ClO3+6H++5Cl===3Cl2↑+3H2O;生成的氯气中混有的HCl气体会与乙醇反应生成氯乙烷,导致三氯乙醛的纯度降低;
(4)该滴定过程中利用Na2S2O3标准溶液滴定未反应的碘单质的物质的量,从而确定与HCOO反应的碘单质的量,继而确定HCOO的量;滴定终点碘单质全部被氧化成碘离子,所以可选用淀粉溶液做指示剂,达到终点的现象为滴入最后一滴Na2S2O3溶液,锥形瓶中的颜色有蓝色变为无色,且半分钟内部恢复原色;
根据反应I2+![]() 可知存在数量关系I2~2 S2O32,则剩余的n(I2)= 0.020 mol/L×0.02L×
可知存在数量关系I2~2 S2O32,则剩余的n(I2)= 0.020 mol/L×0.02L×![]() =0.00020mol,则与HCOO反应的n(I2)= 0.100 mol/L×0.02L-0.00020mol=0.00180mol,根据
=0.00020mol,则与HCOO反应的n(I2)= 0.100 mol/L×0.02L-0.00020mol=0.00180mol,根据![]() ,可知n(CCl3CHO)=0.00180mol, 产品的纯度为
,可知n(CCl3CHO)=0.00180mol, 产品的纯度为![]() 66.4%。
66.4%。