题目内容
现有A、B、C、D四种物质,B、D的焰色反应均为黄色.C是一种强酸的酸式盐,将C加入BaCl2溶液有不溶于盐酸的白色沉淀生成,D晶体在干燥空气中容易逐渐失去结晶水变成白色粉末.对A、B、C、D进行下列实验,实验过程和记录如图所示(无关物质已略去),请回答:
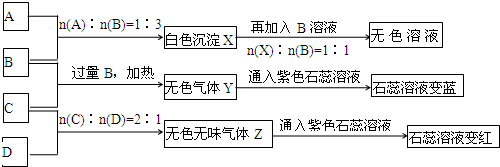
(1)X与B反应的离子方程式为______.
(2)D溶液pH值大于7,原因是(用离子方程式表示)______.
(3)写出C与过量B反应(加热)的离子方程式______.
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序______.
(5)Y在同主族的同类物质中分子稳定性最强______,也是沸点最高的______.(判断正误填“是“或“否“)
(6)若向三份足量的B的稀溶液中分别加入少量稀醋酸、稀硝酸、浓硫酸,均生成1molH2O时的反应热分别为△H1,△H2,△H3,则三者由大到小排序为:______.

(1)X与B反应的离子方程式为______.
(2)D溶液pH值大于7,原因是(用离子方程式表示)______.
(3)写出C与过量B反应(加热)的离子方程式______.
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序______.
(5)Y在同主族的同类物质中分子稳定性最强______,也是沸点最高的______.(判断正误填“是“或“否“)
(6)若向三份足量的B的稀溶液中分别加入少量稀醋酸、稀硝酸、浓硫酸,均生成1molH2O时的反应热分别为△H1,△H2,△H3,则三者由大到小排序为:______.
B、D的焰色反应均为黄色证明含钠元素.C是一种强酸的酸式盐可以判断为NaHSO4,将C加入BaCl2溶液有不溶于盐酸的白色沉淀生成为BaSO4;转化关系中A+3B→白色沉淀X,X+B→无色溶液,根据生成沉淀和沉淀溶解所用B的定量关系可以推断,A为铝盐,B为NaOH,X为Al(OH)3;转化关系中过量的B(NaOH)和C反应生成气体Y使石蕊溶液变蓝证明是氨气,即判断C为硫酸氢铵,Y为NH3,C和D按2:1反应生成气体Z,能使石蕊试液变红,说明气体是酸性气体,结合D晶体在干燥空气中容易逐渐失去结晶水变成白色粉末,判断D为Na2CO3,Z为CO2;
(1)X(Al(OH)3)与B(NaOH)反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)推断D溶液为碳酸钠溶液,pH值大于7,原因是碳酸根离子水解,离子方程式为:CO32-+H2O HCO3-+OH-;HCO3-+H2O?H2CO3+OH-,故答案为:CO32-+H2O
HCO3-+OH-;HCO3-+H2O?H2CO3+OH-,故答案为:CO32-+H2O  HCO3-+OH-;HCO3-+H2O?H2CO3+OH-;
HCO3-+OH-;HCO3-+H2O?H2CO3+OH-;
(3)C(NH4HSO4)与过量B(NaOH)反应(加热)的离子方程式为:NH4++H++2OH-
NH3↑+2H2O,
故答案为:NH4++H++2OH-
NH3↑+2H2O
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,依据电荷守恒可知:C(Na+)+C(NH4+)+C(H+)=C(OH-)+2C(SO42-),C(H+)=C(OH-) C(Na+)+C(NH4+)=2C(SO42-),恰好反应发生的化学反应方程式为:NH4HSO4+2NaOH=Na2SO4+H2O+NH3?H2O,溶液呈碱性,若呈中性,硫酸氢铵稍过量,或氢氧化钠量少,则该溶液中离子浓度从大到小的顺:C(Na+)>C(SO42-)>C(NH4+)>C(H+)=C(OH-),
故答案为:C(Na+)>C(SO42-)>C(NH4+)>C(H+)=C(OH-)
(5)Y为NH3,在同主族的同类物质中,氮元素非金属性最强,所以氢化物的稳定性最强,分子稳定性最强是,氢化物的沸点取决于分子间的作用力,结构相似的分子,相对分子质量越大,沸点越高,但氨气分子间存在氢键,沸点反常的高,
故答案为:是 是;
(6)若向三份足量的B的稀溶液中分别加入少量稀醋酸、稀硝酸、浓硫酸,均生成1molH2O时的反应热分别为△H1,△H2,△H3,醋酸是弱电解质存在电离平衡,和氢氧化钠反应促进电离需吸收热量,浓硫酸溶解过程溶液温度升高,所以反应生成1mol水时的焓变大小需要考虑正负号,反应是放热,焓变是负值,大小为:△H1>△H2>△H3,
故答案为::△H1>△H2>△H3 ;
(1)X(Al(OH)3)与B(NaOH)反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)推断D溶液为碳酸钠溶液,pH值大于7,原因是碳酸根离子水解,离子方程式为:CO32-+H2O
 HCO3-+OH-;HCO3-+H2O?H2CO3+OH-,故答案为:CO32-+H2O
HCO3-+OH-;HCO3-+H2O?H2CO3+OH-,故答案为:CO32-+H2O  HCO3-+OH-;HCO3-+H2O?H2CO3+OH-;
HCO3-+OH-;HCO3-+H2O?H2CO3+OH-;(3)C(NH4HSO4)与过量B(NaOH)反应(加热)的离子方程式为:NH4++H++2OH-
| ||
故答案为:NH4++H++2OH-
| ||
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,依据电荷守恒可知:C(Na+)+C(NH4+)+C(H+)=C(OH-)+2C(SO42-),C(H+)=C(OH-) C(Na+)+C(NH4+)=2C(SO42-),恰好反应发生的化学反应方程式为:NH4HSO4+2NaOH=Na2SO4+H2O+NH3?H2O,溶液呈碱性,若呈中性,硫酸氢铵稍过量,或氢氧化钠量少,则该溶液中离子浓度从大到小的顺:C(Na+)>C(SO42-)>C(NH4+)>C(H+)=C(OH-),
故答案为:C(Na+)>C(SO42-)>C(NH4+)>C(H+)=C(OH-)
(5)Y为NH3,在同主族的同类物质中,氮元素非金属性最强,所以氢化物的稳定性最强,分子稳定性最强是,氢化物的沸点取决于分子间的作用力,结构相似的分子,相对分子质量越大,沸点越高,但氨气分子间存在氢键,沸点反常的高,
故答案为:是 是;
(6)若向三份足量的B的稀溶液中分别加入少量稀醋酸、稀硝酸、浓硫酸,均生成1molH2O时的反应热分别为△H1,△H2,△H3,醋酸是弱电解质存在电离平衡,和氢氧化钠反应促进电离需吸收热量,浓硫酸溶解过程溶液温度升高,所以反应生成1mol水时的焓变大小需要考虑正负号,反应是放热,焓变是负值,大小为:△H1>△H2>△H3,
故答案为::△H1>△H2>△H3 ;

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目



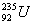 以后的副产品,其主要成分为低水平放射性的
以后的副产品,其主要成分为低水平放射性的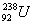 。下列有关
。下列有关