题目内容
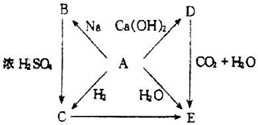
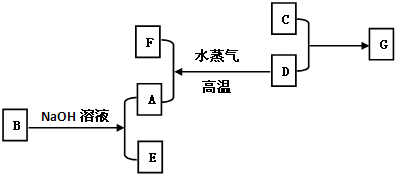
如图是几种中学化学常见物质的转化关系图,其中气体D、E为单质,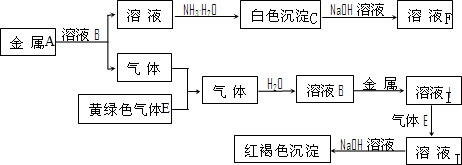
请按要求回答下列问题.
(1)C的化学式是______
(2)写出反应“C→F”的离子方程式______;
(3)写出反应“I→J”的离子方程式______;
(4)写出金属A与NaOH溶液反应的离子方程式______.

请按要求回答下列问题.
(1)C的化学式是______
(2)写出反应“C→F”的离子方程式______;
(3)写出反应“I→J”的离子方程式______;
(4)写出金属A与NaOH溶液反应的离子方程式______.
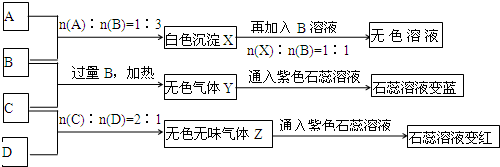
由溶液加一水合氨生成白色沉淀,白色沉淀溶于NaOH溶液,则沉淀C为Al(OH)3,由元素守恒可知,金属A为Al,气体为H2,黄绿色气体E为Cl2,溶液B为HCl,由最后的红褐色沉淀,I为FeCl2,J为FeCl3,
(1)由上述分析可知,C为Al(OH)3,故答案为:Al(OH)3;
(2)反应“C→F”的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)反应“I→J”的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)金属A与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-=AlO2-+3H2↑.
(1)由上述分析可知,C为Al(OH)3,故答案为:Al(OH)3;
(2)反应“C→F”的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)反应“I→J”的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)金属A与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-=AlO2-+3H2↑.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目