题目内容
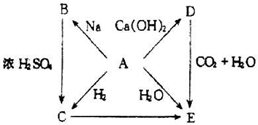
由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图的转换关系,甲是工业上制取A的主要原料.请回答:
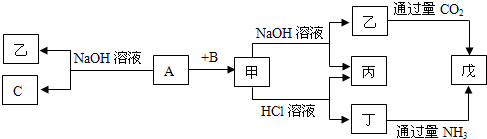
(1)写出下列物质的化学式:A______乙______.
(2)写出甲物质在工业上的任两种主要用途______.
(3)写出下列变化的化学方程式:
①A与NaOH溶液反应的化学方程式______.
②乙与过量CO2反应的离子方程式______.

(1)写出下列物质的化学式:A______乙______.
(2)写出甲物质在工业上的任两种主要用途______.
(3)写出下列变化的化学方程式:
①A与NaOH溶液反应的化学方程式______.
②乙与过量CO2反应的离子方程式______.
甲既能与酸反应又能与碱反应,应为Al2O3或Al(OH)3,甲由单质A和B反应生成,应为Al2O3,且A能与NaOH反应,则A为Al,B为O2,C为H2,乙为NaAlO2,丁为AlCl3,丙为H2O,戊为Al(OH)3,
(1)由上述分析可知,A为Al,乙为NaAlO2,故答案为:;NaAlO2;
(2)甲为氧化铝,其熔点好,则可作耐高温材料、轴承或制取铝单质,故答案为:耐高温材料、轴承或制取铝单质;
(3)①A与NaOH溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
②乙与过量CO2反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(1)由上述分析可知,A为Al,乙为NaAlO2,故答案为:;NaAlO2;
(2)甲为氧化铝,其熔点好,则可作耐高温材料、轴承或制取铝单质,故答案为:耐高温材料、轴承或制取铝单质;
(3)①A与NaOH溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
②乙与过量CO2反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.

练习册系列答案
相关题目