题目内容
【题目】溶液中的化学反应大多是离子反应。根据要求回答问题。
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示:盐碱地产生碱性的原因_________;农业上用石膏降低其碱性的反应原理____________。
(2)已知水存在如下平衡:H2O+H2O![]() H3O++OH-向水中加NaHSO4固体,水的电离平向________移动,且所得溶液显_____性。
H3O++OH-向水中加NaHSO4固体,水的电离平向________移动,且所得溶液显_____性。
(3)若取 pH、体积均相等的NaOH和氨水分别加水稀释 m倍、n稀释后pH仍相等,则 m______n(填“>”“<”或“=”);
(4)常温下,在pH=6的CH3COOH与CH3COONa 的混合溶液中水电离出来的c(OH-)=_________;
(5)在如图坐标纸上画出用0.1000mol/LNaOH滴定20.00mL0.1000mol/LHCl的滴定曲线示意图。
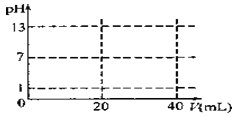 ______
______
【答案】Na2CO3+H2O![]() NaHCO3+NaOH Na2CO3+CaSO4═CaCO3+Na2SO4 逆向 酸 < 1×10-8mol/L
NaHCO3+NaOH Na2CO3+CaSO4═CaCO3+Na2SO4 逆向 酸 < 1×10-8mol/L 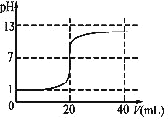
【解析】
(1)从碳酸钠水解角度及沉淀转化角度考虑;
(2)根据电离方程式NaHSO4=Na++H++SO42-分析;
(3)稀释会促进弱电解质的电离,若稀释后pH相等,则稀释后氨水体积较大;
(4)pH=6的CH3COOH与CH3COONa的混合溶液中的氢氧根离子是水的电离的,根据Kw计算水电离的c(OH-);
(5)找出几个关键点,起始点,恰好反应点及碱过量的点,把点连成平滑曲线即可。
(1)碳酸钠水解溶液显碱性,故不利于作物生长,水解的化学方程式为:Na2CO3+H2O![]() NaHCO3+NaOH;
NaHCO3+NaOH;
加入石膏,会和碳酸钠反应生成碳酸钙沉淀,降低了碳酸根离子浓度,所以其土壤碱性降低,反应方程式为:Na2CO3+CaSO4═CaCO3+Na2SO4,
故答案为:Na2CO3+H2O ![]() NaHCO3+NaOH;Na2CO3+CaSO4═CaCO3+Na2SO4;
NaHCO3+NaOH;Na2CO3+CaSO4═CaCO3+Na2SO4;
(2)硫酸氢钠的电离方程式为:NaHSO4=Na++H++SO42-,电离出H+,使溶液显酸性,抑制水的电离,
故答案为:逆向;酸;
(3)稀释会促进弱电解质的电离,故若取pH、体积均相等的NaOH和氨水分别加水稀释m倍、n稀释后pH仍相等,则氨水稀释倍数大,故答案为:<;
(4)pH=6的CH3COOH与CH3COONa的混合溶液中,醋酸的电离程度大于醋酸根离子的水解程度,则溶液呈酸性,该混合液中的氢氧根离子是水的电离的,则水电离出的c(OH-)=![]() =
=![]() mol/L=10-8mol/L;
mol/L=10-8mol/L;
(5)当氢氧化钠体积为0时,溶液pH为1,当二者恰好反应时,消耗氢氧化钠溶液体积为20mL,此时溶液的pH=7,若碱过量,则溶液pH增大,最大不会大于0.1mol/LNaOH溶液的pH(13),接近滴定终点出现突变,由此作出滴定曲线示意图为: 。
。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案