题目内容
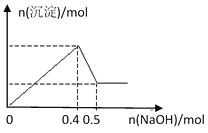
【题目】现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl- 与SO42-的物质的量之比为
A. 1:3B. 1:6
C. 2:3D. 3:2
【答案】C
【解析】
由图可知加入0.4molNaOH,沉淀达最大量,沉淀为氢氧化镁、氢氧化铝,根据氢氧根守恒可知2n[Mg(OH)2]+3n[Al(OH)3]=n(OH-)=0.4mol,加入0.5molNaOH时,沉淀由最大值减小为最小值,故0.1molNaOH溶解氢氧化铝沉淀,根据反应Al(OH)3+NaOH=NaAlO2+2H2O可知,n[Al(OH)3]=0.1mol,所以2n[Mg(OH)2]+3×0.1mol=0.4mol,故n[Mg(OH)2]=0.05mol,根据化学式MgCl2可知溶液中n(Cl-)=2n[Mg(OH)2]=2×0.05mol=0.1mol,根据化学式Al2(SO4)3可知溶液中n(SO42-)=![]() n[Al(OH)3]=
n[Al(OH)3]= ![]() ×0.1mol=0.15mol,所以原溶液中Cl-与SO42-的物质的量之比为0.1mol:0.15mol=2:3;
×0.1mol=0.15mol,所以原溶液中Cl-与SO42-的物质的量之比为0.1mol:0.15mol=2:3;
故选:C。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案【题目】A、B、C、D、E、 F、G、H是周期表中前四周期的七种元素,有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 地壳中含量最多的元素 |
B | B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的 |
C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
D | D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
E | E与D同周期,且在该周期中原子半径最小 |
F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
G | G是形成化合物种类最多的元素 |
H | H是与D相邻的同主族元素,且原子半径:H>D |
(1) B元素符号为________ ,A与C以原子个数比为1:1形成的化合物的电子式为_______ ,用电子式表示C与E形成化合物的过程________ 。
(2) A、C、E所形成简单离子半径由大到小的顺序是____________ ,H的最高价氧化物对应水化物的化学式为_________ ,A、D、H的氢化物的沸点由高到低的顺序为____________________ 。
(3) 非金属性D_________ E(填“大于”或“小于”)。下列事实能证明这一结论的是________ (选填字母序号)。
a.E的熔点低于D
b.氢化物的还原性:D > E
c.最高价氧化物对应的水化物酸性:E > D
d.氢化物的酸性:E >D