题目内容
现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱,部分工艺流程如下:
有关说法错误的是
| A.反应Ⅰ原理为CO2 + NH3 + NaCl + H2O → NaHCO3↓ + NH4Cl |
| B.向饱和NaCl溶液中先通入足量的CO2,再通入足量的NH3 |
| C.反应Ⅰ生成的沉淀,经过过滤、洗涤、煅烧可得到纯碱 |
| D.往母液中通入氨气,加入细小的食盐颗粒并降温,可使氯化铵析出 |
B
解析试题分析:A、正确;B、先通入NH3形成碱性溶液再吸收CO2形成碳酸氢盐,错误;C、反应Ⅰ生成的碳酸氢钠受热分解生成碳酸钠,正确;D、这些措施均能降低氯化铵的溶解度使其析出,正确。
考点:考查化工流程中的反应原理有关问题。

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
将21.8gNa2O2与Na2O的混合物投入足量的水中溶解,称得水溶液增重18.6g,则原混合物中Na2O2与Na2O的物质的量之比是( )
| A.1:1 | B.1:2 | C.2:1 | D.2:3 |
下列反应与Na2O2+SO2→Na2SO4相比较,Na2O2的作用相同的是
| A.2Na2O2+2CO2→2Na2CO3+O2 | B.2Na2O2+2SO3→2Na2SO4+O2 |
| C.2Na2O2+H2SO4→Na2SO4+H2O2 | D.3Na2O2+Cr2O3→2Na2CrO4+Na2O |
下列陈述Ⅰ和Ⅱ正确并且有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 浓H2SO4有吸水性 | 浓H2SO4可用于干燥氨气 |
| B | SO2有氧化性 | SO2尾气可用NaOH溶液吸收 |
| C | Mg有还原性 | 电解MgCl2饱和溶液可制备Mg |
| D | NH3和HCl在水中溶解度很大 | 充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升 |
下列说法正确的是
| A.汽油、柴油、植物油都属烃类物质且均为纯净物 |
| B.单质硅常用于制造芯片和光导纤维 |
| C.等质量的气态乙醇和液态乙醇分别完全燃烧,前者放出的热量更多 |
| D.漂白精和明矾都常用于自来水的处理,二者作用原理相同 |
A~D是含同一元素的四种物质,它们相互之间有如图所示的转化关系,其中A是单质,D
是氢氧化物,则A可能是( )
①Al ②Mg ③Fe ④Na
| A.①③ | B.①②③ | C.①② | D.②③④ |
下列说法正确的是
| A.将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁 |
| B.饱和FeCl3溶液在20℃时呈现棕黄色,100℃呈现红褐色,不能用平衡移动原理来解释 |
| C.在c(H+)/c(OH-)= l012 溶液中 N a+、I-、NO3-、SO42-不能大量共存 |
| D.在原电池装置中,电子从负极流出,沿导线流入正极,经溶液或盐桥回到负极 |
工业上焙烧明矾[ (SO4)2·12H2O]的化学方程式为:4Al(SO4)2·12H2O+3S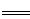 2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
| A.在焙烧明矾的反应中,还原剂与氧化剂的物质的量之比是3:4 |
| B.最后得到的K2SO4溶液呈中性,所以c(K+)=c(SO42-) |
| C.焙烧产生的SO2可用于制硫酸,焙烧948 t明矾(M=" 474" g/mol),若SO2的利用率为96%,可生产质量分数为98%的硫酸432 t |
D.工业上冶炼Al2O3制得Al,以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是Al+3NiO(OH)+NaOH  NaAlO2+3Ni(OH)2 NaAlO2+3Ni(OH)2 |
海洋中有丰富的食品、矿产、能源、药物和水产资源,对今后世界经济发展有着决定性作用。下列有关说法正确的是
| A.整个过程可在实验室中模拟进行 |
| B.工段②是风化过程 |
| C.在工段③④⑤中溴元素均被氧化 |
D.工段①中除去粗盐中的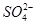 、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |