题目内容
A~D是含同一元素的四种物质,它们相互之间有如图所示的转化关系,其中A是单质,D
是氢氧化物,则A可能是( )
①Al ②Mg ③Fe ④Na
| A.①③ | B.①②③ | C.①② | D.②③④ |
C
解析试题分析:据题意满足该转化关系的关键是“D(氢氧化物)→B(氧化物)”,③中的“Fe(OH)3不能一步转化为Fe3O4”,④中的“NaOH不能一步转化为Na2O”,故只有Al、Mg元素满足要求。
考点:考查金属(Na、Mg、Al、Fe)及其化合物的转化关系。

练习册系列答案
相关题目
下列有关物质性质的应用错误的是
| A.H2O2溶液有氧化性,可用于杀菌消毒 |
| B.氯化镁是一种电解质,可用于电解法制镁 |
| C.液氨汽化时要吸收大量的热,可用作制冷剂 |
| D.Na2SO4能使蛋白质发生变性,可用于提纯蛋白质 |
微粒甲与离子乙在溶液中的转化关系如下图所示:微粒甲是( )
| A.Si | B.Na+ | C.Al | D.SO2 |
下列因果关系叙述正确的是
| A.SO2具有漂白性,故可使酸性KMnO4溶液褪色 |
| B.浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 |
| C.Na的金属性比Cu强,故可用Na与CuSO4溶液反应制取Cu |
| D.Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中Fe也显+3价 |
现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱,部分工艺流程如下:
有关说法错误的是
| A.反应Ⅰ原理为CO2 + NH3 + NaCl + H2O → NaHCO3↓ + NH4Cl |
| B.向饱和NaCl溶液中先通入足量的CO2,再通入足量的NH3 |
| C.反应Ⅰ生成的沉淀,经过过滤、洗涤、煅烧可得到纯碱 |
| D.往母液中通入氨气,加入细小的食盐颗粒并降温,可使氯化铵析出 |
硫酸亚铁是一种重要的化工原料,可以制备多种物质。有关下列制备方法错误的是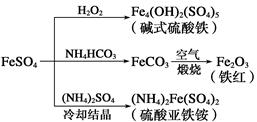
| A.制备碱式硫酸铁利用了过氧化氢的氧化性 |
| B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 |
| C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 |
| D.制备(NH4)2Fe(SO4)2利用了它的溶解度比FeSO4的溶解度大这一性质 |
将一定量的氯气通入30mL浓度为10.00 mol·L-1的NaOH浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
| A.与NaOH反应的氯气一定为0.3mol |
| B.n(Na+):n(Cl-)可能为7:3 |
| C.若反应中转移的电子为n mol ,则0.15<n<0.25 |
| D.n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 |
工业上用铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)为原料冶炼铝的工艺流程如下,对下述流程中的判断正确的是: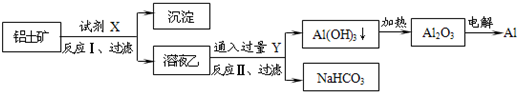
| A.试剂X为稀硫酸,沉淀中含有硅的化合物 |
| B.反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
| C.结合质子(H+)的能力由弱到强的顺序是OH->CO32->AlO2- |
| D.Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |