��Ŀ����
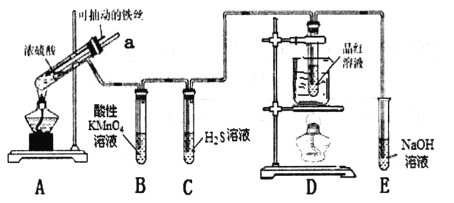
����Ŀ��Ǧ����������Ķ��ε�أ��乹��ʾ��ͼ���¡�������Ӧ�Ļ�ѧ����ʽΪ��
Pb(s) + PbO2(s) + 2H2SO4(aq) ![]() 2PbSO4(s) + 2H2O(l)
2PbSO4(s) + 2H2O(l)
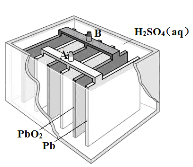
����˵������ȷ����
A���ŵ�ʱ��������ӦΪ��PbO2(s) + 4H+(aq) + SO42-(aq) +2e- = PbSO4(s) + 2H2O(l)
B�����ʱ��Ӧ�����ֱ����Դ��������Ǧ���صĽ�����A���
C��ʵ������Ǧ��������Դ������ͭʱ��Ӧ����ͭ�������B������
D��Ǧ��������Դ���Na2SO4��Һʱ������2 mol O2����ʱ������8 mol H2SO4
���𰸡�B
��������
���������A���ŵ�ʱ����ԭ����������õ��ӷ�����ԭ��Ӧ����ȷ��B�� A��Ǧ�壬Ӧ���Դ����������������C�� ��ͭ��������B��PbO2������������ȷ��D��2Ħ������ת��8Ħ�����ӣ������ÿת��2Ħ�����ӣ�����2Ħ��������������������8Ħ������ȷ��

����Ŀ����Ļ������ڿ��С������ѧ��ҵ�о�����Ҫ�����á�
��1���ڷ�ˮ���������У�H2S��Na2S��ʹijЩ�����������ɼ����ܵ��������ȥ��25 ������0.10 mol��L��1 H2S��Һ�У�ͨ��HCl��������NaOH�����Ե�����ҺpH����ҺpH��c(S2��)��ϵ���±�(������Һ����ı仯��H2S�Ļӷ�)��
pH | 3 | 5 | 7 | 9 | 11 |
c(S2��)/ (mol��L��1) | 1.4��10��15 | 1.4��10��11 | 6.8��10��8 | 1.3��10��5 | 1.3��10��3 |
ij��Һ��0.020 mol��L��1 Mn2����0.10 mol��L��1 H2S������Һ��pH��5ʱ��Mn2����ʼ������MnS���ܶȻ�Ϊ______��
��2����ҵ�ϲ��ø��·ֽ�H2S��ȡ�������䷴ӦΪ2H2S(g)![]() 2H2(g)��S2(g)����H1����Ĥ��Ӧ���з����H2��
2H2(g)��S2(g)����H1����Ĥ��Ӧ���з����H2��
����֪��H2S(g)![]() H2(g)��S(g)����H2��2S(g)
H2(g)��S(g)����H2��2S(g)![]() S2(g)����H3������H1��______ (�ú���H2����H3��ʽ�ӱ�ʾ)��
S2(g)����H3������H1��______ (�ú���H2����H3��ʽ�ӱ�ʾ)��
�����ܱ������У�����0.10 mol H2S(g)��������Ӧ2H2S(g)![]() 2H2(g)��S2(g)�����Ʋ�ͬ���¶Ⱥ�ѹǿ����ʵ�飬�����ͼ��ʾ��
2H2(g)��S2(g)�����Ʋ�ͬ���¶Ⱥ�ѹǿ����ʵ�飬�����ͼ��ʾ��
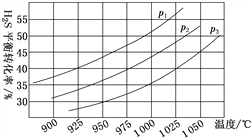
ͼ��ѹǿp1��p2��p3�ɴ�С��˳��Ϊ______��������______�����������ݻ�Ϊ2.0 L����ѹǿΪp3���¶�Ϊ950 ��ʱ����Ӧ��3 h�ﵽƽ�⣬��ѧ��Ӧ����v(S2)��______����ѹǿp2��7.2 MPa���¶�Ϊ975 ��ʱ���÷�Ӧ��ƽ�ⳣ��Kp��______����ƽ���ѹ����ƽ��Ũ������ѹ����ѹ�����ʵ���������������������λ��Ч���֣���������ѹǿ���䣬������1000 ��ʱ����÷�Ӧ��ƽ�ⳣ��_____��������������������������С������
��3����ҵ���ö��Ե缫���KHSO4������Һ��ȡH2O2��ʾ��ͼ��ͼ��ʾ��
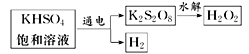
�ٵ��µ��KHSO4������Һʱ�����ĵ缫��ӦʽΪ______��
��K2S2O8ˮ��ʱ����H2O2��KHSO4���÷�Ӧ�Ļ�ѧ����ʽ______��
����Ŀ�������£��ش����й�����ͼ��кͷ�Ӧ������:
��ijһԪ��HA ��NaOH��Һ�������ϣ��ֱ���б�Ţ١��ڡ��۵�ʵ�飬ʵ�����ݼ�¼�±�
��� | HA���ʵ���Ũ��(mol/L) | NaOH���ʵ���Ũ��(mol/L) | �����Һ��pH |
�� | 0.1 | 0.1 | pH=9 |
�� | c | 0.2 | pH=7 |
�� | 0.2 | 0.1 | pH>9 |
��ش�:
(1)���ݢ���ʵ������������ҺpH=9��ԭ����_____________(�����ӷ���ʽ��ʾ)��
(2)�����Һ������ˮ�������c (H+)_____0.1moI/LNaOH��Һ����ˮ�������c(H+)��(�>����<����=��)
(3)���ݢ���ʵ��������ڸ���Һ�����й�ϵʽ��ȷ����(�������ĸ)______��
A.c(Na+)+c(H+) =c(OH-) +c(A-)
B.c(Na+) =c(HA) +c(A-)
C.c (HA)+c(H+) =c(OH-)
D.c(Na+) +c(H+) =c(OH-) +c(A-) +c (HA)
(4)�������������c_________0.2mol/L (ѡ�>������<����=��)�������Һ������Ũ��c(A-)____c(Na+) (ѡ�>������<����=��)��
(5)�Ӣ���ʵ��������������Ũ���ɴ�С��˳����_________________________��