题目内容
【题目】常温下,回答下列关于酸和碱中和反应的问题:
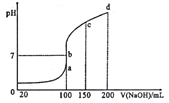
将某一元酸HA 和NaOH溶液等体积混合,分别进行编号①、②、③的实验,实验数据记录事表
序号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH>9 |
请回答:
(1)根据①组实验情况,混合溶液pH=9的原因是_____________(用离子方程式表示)。
(2)混合溶液①中由水电离出的c (H+)_____0.1moI/LNaOH溶液中由水电离出的c(H+)。(填“>”“<”或“=”)
(3)根据①组实验情况,在该溶液中下列关系式正确的是(填序号字母)______。
A.c(Na+)+c(H+) =c(OH-) +c(A-)
B.c(Na+) =c(HA) +c(A-)
C.c (HA)+c(H+) =c(OH-)
D.c(Na+) +c(H+) =c(OH-) +c(A-) +c (HA)
(4)②组情况表明,c_________0.2mol/L (选填“>”、“<”或“=”)。混合溶液中离子浓度c(A-)____c(Na+) (选填“>”、“<”或“=”)。
(5)从③组实验结果分析,离子浓度由大到小的顺序是_________________________。
【答案】 A-+H2O![]() HA+OH- > ABC > = c (Na+) >c (A-) >c (OH-) >c (H+)
HA+OH- > ABC > = c (Na+) >c (A-) >c (OH-) >c (H+)
【解析】本题主要考查有关中和反应及盐类水解的判断和计算。
(1)根据①组实验情况,中和反应恰好完全进行,形成NaA溶液,混合溶液pH=9的原因是NaA水解使溶液呈碱性,A-+H2O![]() HA+OH-。
HA+OH-。
(2)盐类水解促进水的电离,酸、碱抑制水的电离,所以混合溶液①中由水电离出的c(H+)>0.1moI/LNaOH溶液中由水电离出的c(H+)。
(3)根据①组实验情况,形成NaA的溶液,NaA水解使溶液呈碱性。A.电荷守恒:c(Na+)+c(H+)=c(OH-)+c(A-),故A正确;B.元素守恒:c(Na+)=c(HA)+c(A-),故B正确;
C.质子守恒:c(HA)+c(H+)=c(OH-),故C正确;D.电荷守恒:c(Na+)+c(H+)=c(OH-)+c(A-),c(HA)≠0,所以c(Na+)+c(H+)≠c(OH-)+c(A-)+c(HA),故D错误。故选ABC。
(4) 若c=0.2mol/L,中和反应恰好完全进行,形成NaA溶液,NaA水解使溶液呈碱性。②组情况表明pH=7,所以c>0.2mol/L。混合溶液中电荷守恒:c(Na+)+c(H+)=c(OH-)+c(A-),而且c(H+)=c(OH-),所以c(A-)=c(Na+)。
(5)从③组实验结果分析,形成等浓度的HA、NaA的混合溶液,pH>9表明NaA的水解程度大于HA的电离程度,所以离子浓度由大到小的顺序是c (Na+) >c (A-) >c (OH-) >c (H+)。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】硼、镁及其化合物在工农业生产中应用广泛。已知:硼镁矿主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O,利用硼镁矿制取金属镁及粗硼的工艺流程如下,请回答下列有关问题:
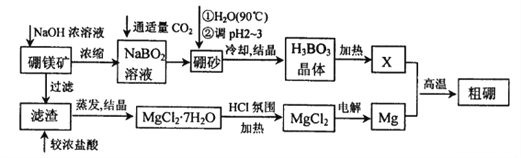
(1)硼砂中B的化合价为_________;滤渣的主要成分为_______________。
(2)X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为_________________________。
(3)H3BO3是一种一元弱酸,也可写作B(OH)3,它与水作用时结合水电离的OH-而呈酸性,这一变化的离子方程式为______________________________。
(4)MgCl2·6H2O需要在HCl氛围中加热,其目的是______________________。
(5)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
pH | <8.0 | 8.0~9.6 | >9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为_______________。