题目内容
【题目】硫的化合物在科研、生活及化学工业中具有重要的作用。
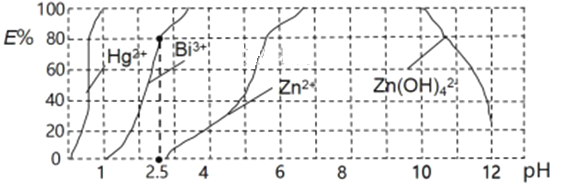
(1)在废水处理领域中,H2S或Na2S能使某些金属离子生成极难溶的硫化物而除去。25 ℃,在0.10 mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如下表(忽略溶液体积的变化、H2S的挥发)。
pH | 3 | 5 | 7 | 9 | 11 |
c(S2-)/ (mol·L-1) | 1.4×10-15 | 1.4×10-11 | 6.8×10-8 | 1.3×10-5 | 1.3×10-3 |
某溶液含0.020 mol·L-1 Mn2+、0.10 mol·L-1 H2S,当溶液的pH=5时,Mn2+开始沉淀,MnS的溶度积为______。
(2)工业上采用高温分解H2S制取氢气,其反应为2H2S(g)![]() 2H2(g)+S2(g) ΔH1,在膜反应器中分离出H2。
2H2(g)+S2(g) ΔH1,在膜反应器中分离出H2。
①已知:H2S(g)![]() H2(g)+S(g) ΔH2;2S(g)
H2(g)+S(g) ΔH2;2S(g)![]() S2(g) ΔH3,则ΔH1=______ (用含ΔH2、ΔH3的式子表示)。
S2(g) ΔH3,则ΔH1=______ (用含ΔH2、ΔH3的式子表示)。
②在密闭容器中,充入0.10 mol H2S(g),发生反应2H2S(g)![]() 2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如图所示。
2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如图所示。
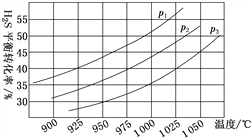
图中压强p1、p2、p3由大到小的顺序为______,理由是______。若容器的容积为2.0 L,则压强为p3,温度为950 ℃时,反应经3 h达到平衡,化学反应速率v(S2)=______;若压强p2=7.2 MPa、温度为975 ℃时,该反应的平衡常数Kp=______(用平衡分压代替平衡浓度,分压=总压×物质的量分数,计算结果保留两位有效数字)。若保持压强不变,升温至1000 ℃时,则该反应的平衡常数_____(填“增大”“不变”或“减小”)。
(3)工业上用惰性电极电解KHSO4饱和溶液制取H2O2,示意图如图所示:
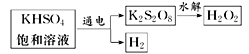
①低温电解KHSO4饱和溶液时阳极的电极反应式为______。
②K2S2O8水解时生成H2O2和KHSO4,该反应的化学方程式______。
【答案】 2.8×10-13 2ΔH2+ΔH3 p3>p2>p1 该反应的正反应为气体分子数增加的反应,其他条件相同时,压强增大平衡逆向移动,H2S的转化率减小,故p3>p2>p1 0.0025 mol·L-1·h-1 0.53 增大 2SO![]() -2e-===S2O
-2e-===S2O![]() K2S2O8+2H2O===H2O2+2KHSO4
K2S2O8+2H2O===H2O2+2KHSO4
【解析】试题分析:(1)某溶液含0.020 molL-1Mn2+、0.1 molL-1H2S,当溶液的pH=5时,溶液里c(S2-)=1.4×10-11molL-1,Mn2+开始沉淀,则MnS的溶度积= c(S2-)×c(Mn2+)=0.020×1.4×10-11=2.8×10-13; (2)工业上采用高温分解H2S制取氢气,其反应为2H2S(g)![]() 2H2(g)+S2(g) △H1,在膜反应器中分离出H2。①ⅰH2S(g)
2H2(g)+S2(g) △H1,在膜反应器中分离出H2。①ⅰH2S(g)![]() H2(g)+S(g) △H2,ⅱ2S(g)
H2(g)+S(g) △H2,ⅱ2S(g)![]() S2(g)△H3,根据盖斯定律可知2H2S(g)
S2(g)△H3,根据盖斯定律可知2H2S(g)![]() 2H2(g)+S2(g)为ⅰ×2+ⅱ得到的,故△H1=2ΔH2+ ΔH3;②因为恒温下压强越大,H2S的转化率越低,则图中压强p1、p2、p3由大到小的顺序为p3>p2>p1,理由是该反应的正反应为气体分子数增加的反应,其他条件相同时,压强增大平衡逆向移动,H2S 的转化率减小,故p3>p2>p1。压强为p3,温度为950℃时,H2S的转化率为30%,即变化量为0.10mol×30%=0.03mol,生成的S2(g)为0.03mol/2=0.015mol,达到平衡时v(S2)="(" 0.015mol/2L)÷3h=0.0025mol/(L·h);若压强p2=7.2MPa,温度为975℃时,H2S的转化率为40%,即变化量为0.10mol×40%=0.04mol,则平衡时H2(g)为0.04mol,S2(g)的物质的量为0.02mol,H2S(g)的物质的量为0.06mol,总的物质的量为0.12mol,H2S(g)、H2(g)、S2(g)的分压分别为7.2MPa×(0.06/0.12)=3.6MPa,7.2MPa×(0.04/0.12)=2.4MPa,7.2MPa×(0.02/0.12)=1.2MPa,则反应的平衡常数Kp=(2.4MPa)2×1.2MPa÷(3.6MPa)2=0.53MPa,因恒压条件下,温度越高,H2S的转化率越大,说明升高温度平衡正向移动,若保持压强不变,升温到1000℃时,则该反应的平衡常数增大;(3)①低温电解饱和KHSO4溶液时阳极的电极反应式为2SO4 22e=S2O82;②K2S2O8水解时生成H2O2和KHSO4,该反应的化学方程式为K2S2O8+ 2H2O = H2O2+2KHSO4。
2H2(g)+S2(g)为ⅰ×2+ⅱ得到的,故△H1=2ΔH2+ ΔH3;②因为恒温下压强越大,H2S的转化率越低,则图中压强p1、p2、p3由大到小的顺序为p3>p2>p1,理由是该反应的正反应为气体分子数增加的反应,其他条件相同时,压强增大平衡逆向移动,H2S 的转化率减小,故p3>p2>p1。压强为p3,温度为950℃时,H2S的转化率为30%,即变化量为0.10mol×30%=0.03mol,生成的S2(g)为0.03mol/2=0.015mol,达到平衡时v(S2)="(" 0.015mol/2L)÷3h=0.0025mol/(L·h);若压强p2=7.2MPa,温度为975℃时,H2S的转化率为40%,即变化量为0.10mol×40%=0.04mol,则平衡时H2(g)为0.04mol,S2(g)的物质的量为0.02mol,H2S(g)的物质的量为0.06mol,总的物质的量为0.12mol,H2S(g)、H2(g)、S2(g)的分压分别为7.2MPa×(0.06/0.12)=3.6MPa,7.2MPa×(0.04/0.12)=2.4MPa,7.2MPa×(0.02/0.12)=1.2MPa,则反应的平衡常数Kp=(2.4MPa)2×1.2MPa÷(3.6MPa)2=0.53MPa,因恒压条件下,温度越高,H2S的转化率越大,说明升高温度平衡正向移动,若保持压强不变,升温到1000℃时,则该反应的平衡常数增大;(3)①低温电解饱和KHSO4溶液时阳极的电极反应式为2SO4 22e=S2O82;②K2S2O8水解时生成H2O2和KHSO4,该反应的化学方程式为K2S2O8+ 2H2O = H2O2+2KHSO4。

【题目】为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂或分离方法不正确的是
选项 | 提纯的物质 | 除杂试剂 | 分离方法 |
A | 乙炔(硫化氢) | 硫酸铜溶液 | 洗气 |
B | 苯(苯酚) | 浓溴水 | 过滤 |
C | 乙醇(乙酸) | 生石灰 | 蒸馏 |
D | 苯甲酸(可溶性杂质) | 水 | 重结晶 |
A. A B. B C. C D. D