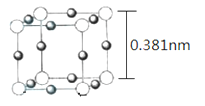
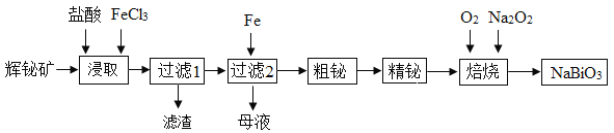
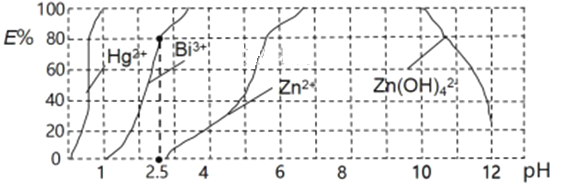
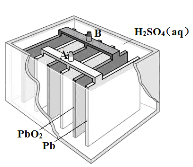
题目内容
【题目】下列说法正确的是
A. 0.1mol/LpH为9的NaHB溶液中:c(HB-)>c(B2-)>c(H2B)
B. 将标准状况下的2.24LCO2通入150mL1mol/LNaOH溶液中,所得溶液中c(CO32-)>c(HCO3-)
C. 室温下,c(NH4+)相同的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2溶液浓度大小顺序为:①>②>③
D. 常温时①pH=12的氨水②pH=12的NaOH溶液,将两溶液稀释相同倍数后溶液的pH:②>①
【答案】C
【解析】A. 0.1mol/L的NaHB溶液的pH为9,表明HB-的水解程度大于电离程度,所以c(HB-)>c(H2B) >c(B2-),故A错误;B. CO2的物质的量为0.1mol,NaOH的物质的量为0.15mol,发生反应:3NaOH+2CO2![]() NaHCO3+Na2CO3+H2O,Na2CO3的水解程度大于NaHCO3,所以所得溶液中c(CO32-)<c(HCO3-),故B错误;C. 室温下,①CO32-与NH4+水解互促,②NH4+水解不受其它成分影响,③Fe2+与NH4+水解相互抑制,因此,c(NH4+)相同的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2溶液浓度大小顺序为:①>②>③,故C正确;D.NaOH是强碱,一水合氨是弱碱, 稀释促进一水合氨电离,所以常温时①pH=12的氨水②pH=12的NaOH溶液两溶液稀释相同倍数后溶液的pH:②<①,故D错误。故选C。
NaHCO3+Na2CO3+H2O,Na2CO3的水解程度大于NaHCO3,所以所得溶液中c(CO32-)<c(HCO3-),故B错误;C. 室温下,①CO32-与NH4+水解互促,②NH4+水解不受其它成分影响,③Fe2+与NH4+水解相互抑制,因此,c(NH4+)相同的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2溶液浓度大小顺序为:①>②>③,故C正确;D.NaOH是强碱,一水合氨是弱碱, 稀释促进一水合氨电离,所以常温时①pH=12的氨水②pH=12的NaOH溶液两溶液稀释相同倍数后溶液的pH:②<①,故D错误。故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案【题目】为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂或分离方法不正确的是
选项 | 提纯的物质 | 除杂试剂 | 分离方法 |
A | 乙炔(硫化氢) | 硫酸铜溶液 | 洗气 |
B | 苯(苯酚) | 浓溴水 | 过滤 |
C | 乙醇(乙酸) | 生石灰 | 蒸馏 |
D | 苯甲酸(可溶性杂质) | 水 | 重结晶 |
A. A B. B C. C D. D