题目内容
【题目】实验密为探究铁与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法错误的是
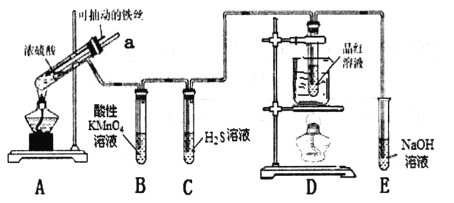
A. 装置B中酸性KMnO4溶液逐渐褪色,体现了二氧化硫的还原性
B. 实验结束后可向装置A 的溶液中滴加KSCN溶液检验是否有Fe2+
C. 装置D中品红溶液褪色可以验证SO2的漂白性
D. 实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸
【答案】B
【解析】该实验向探究铁与浓硫酸在加热条件下的反应,并验证SO2的性质,A装置即为铁与浓硫酸的反应装置,产生SO2;B、C、D装置分别是验证SO2的性质,E装置为尾气处理装置。A、装置B中酸性KMnO4溶液逐渐褪色,说明SO2被氧化,即体现了二氧化硫的还原性,故A正确;B、KSCN溶液是用来检验是否有Fe3+,故B错误;C、品红溶液就是用来检验物质的漂白性,故装置D中品红溶液褪色可以验证SO2的漂白性,故C正确;D、实验时将导管a插入浓硫酸中,可以使A中试管内压强与外界压强相等,即可防止装置B中的溶液倒吸,故D正确;故选B。

 三新快车金牌周周练系列答案
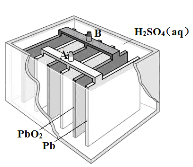
三新快车金牌周周练系列答案【题目】硼、镁及其化合物在工农业生产中应用广泛。已知:硼镁矿主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O,利用硼镁矿制取金属镁及粗硼的工艺流程如下,请回答下列有关问题:
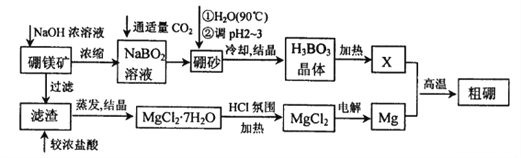
(1)硼砂中B的化合价为_________;滤渣的主要成分为_______________。
(2)X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为_________________________。
(3)H3BO3是一种一元弱酸,也可写作B(OH)3,它与水作用时结合水电离的OH-而呈酸性,这一变化的离子方程式为______________________________。
(4)MgCl2·6H2O需要在HCl氛围中加热,其目的是______________________。
(5)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
pH | <8.0 | 8.0~9.6 | >9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为_______________。