题目内容
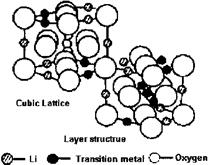
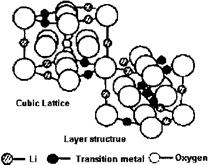
锂电池由于其安全可靠的性能,体积小、质量轻、高效能及可逆等卓越品质被广泛应用于移动电话、笔记本电脑、数码相机等便携式电子器材中。下图为锂电池工作原理图,阴极材料由LiMO2(M=Co,Ni,V,Mn)构成,阳极材料由石墨构成,阴、阳两极之间用半透膜隔开,充电时锂离子由阴极向阳极迁移,放电时则相反,电池可表示为:
(-)Cn/LiClO4/LiMO2(+)

⑴写出锂电池充放电时的可逆电极反应。
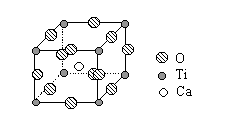
⑵根据上图所示的LiMO2的尖晶石结构,写出氧的堆积方式,并指出Li和M占据何种空隙,画出以氧为顶点的一个晶胞。
⑶锂离子在阳极与石墨形成固体混合物,试推测并画出锂离子嵌入石墨的可能结构。
⑷早期的阳极材料用的是锂金属,试指出锂金属作阳极材料的不足,并说明还可以用什么物质替代石墨作阳极材料?
(-)Cn/LiClO4/LiMO2(+)

⑴写出锂电池充放电时的可逆电极反应。
⑵根据上图所示的LiMO2的尖晶石结构,写出氧的堆积方式,并指出Li和M占据何种空隙,画出以氧为顶点的一个晶胞。
⑶锂离子在阳极与石墨形成固体混合物,试推测并画出锂离子嵌入石墨的可能结构。
⑷早期的阳极材料用的是锂金属,试指出锂金属作阳极材料的不足,并说明还可以用什么物质替代石墨作阳极材料?
⑴ Cathode: LiMO2=Li1-xMO2+xLi++xe
Anode: nC+xLi++xe=LixCn
正反应为充电、逆反应为放电反应。(4分)
⑵ O:立方面心密堆积;Li和M占据八面体空隙;(1分)
以氧为顶点的一个晶胞表示如下:
 (2分)
(2分)
⑶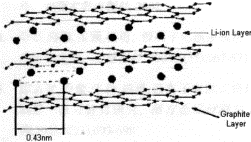 (3分)
(3分)
⑷锂活泼,易与电解质反应,形成锂的枝状晶体,导致电池被侵蚀或爆炸。(1分)
还可用低熔点的金属如Si,Bi,Pb,Sn,Cd等与锂掺杂形成金属合金,或用电解质如液体电解质LiPF6,LiBF6,LiAsF6及LiOSO2CF3(有机溶剂不能含水),以及固体电解质等。(1分)
Anode: nC+xLi++xe=LixCn
正反应为充电、逆反应为放电反应。(4分)
⑵ O:立方面心密堆积;Li和M占据八面体空隙;(1分)
以氧为顶点的一个晶胞表示如下:
 (2分)
(2分)⑶
 (3分)
(3分)⑷锂活泼,易与电解质反应,形成锂的枝状晶体,导致电池被侵蚀或爆炸。(1分)
还可用低熔点的金属如Si,Bi,Pb,Sn,Cd等与锂掺杂形成金属合金,或用电解质如液体电解质LiPF6,LiBF6,LiAsF6及LiOSO2CF3(有机溶剂不能含水),以及固体电解质等。(1分)
⑴该锂电池的充、放电过程是Li离子的嵌入与脱嵌的过程(因为充电时Li+由阴极向阳极迁移,放电时相反),电池内部载荷离子为Li+。因此充电时,
阳极: xLi++Cn+xe-→LixCn
阴极:LiMO2-xe-→Li1-xMO2+xLi+
放电时反应反方向进行。
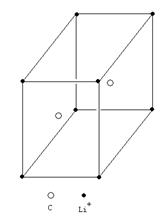
⑵根据题意——LiMO2为尖晶石结构,该结构中,O2-呈面心立方密堆积,Li+和M交替地填满所有的八面体空隙。从图上可知,该种画法中M3+、Li+的原子分数坐标为:(0,0,0),(1/2,1/2,0),(1/2,0,1/2),(0,1/2,1/2)——即交替地分布于顶点和面心;而O2-的原子分数坐标为(1/2,0,0),(0,1/2,0),(0,0,1/2),(1/2,1/2,1/2),即棱心和体心的位置。因此坐标发生移,将O2-平移到晶胞顶点的位置后,M3+、Li+交替位于晶胞的棱心和体心的位置。如下图所示:
⑶Li+嵌入石墨的层状结构之间,碳原子与锂离子之间发生一定的静电作用,石墨体积稍微变大。最大程度地嵌入时,锂离子呈简单六方晶体,晶胞结构示意图如下:
⑷锂是活泼金属,因此易与电解质反应,形成锂的枝状晶体,导致电池被侵蚀或爆炸。能够代替石墨的材料至少要满足这几个条件:一是不能锂发生化学反应,二最好是层状结构,以便嵌入Li+,三是能导电。所以还可用低熔点的金属如Si,Bi,Pb,Sn,Cd等与锂掺杂形成金属合金,或用电解质如液体电解质LiPF6,LiBF6,LiAsF6及LiOSO2CF3(有机溶剂不能含水),以及固体电解质等。
阳极: xLi++Cn+xe-→LixCn
阴极:LiMO2-xe-→Li1-xMO2+xLi+
放电时反应反方向进行。
⑵根据题意——LiMO2为尖晶石结构,该结构中,O2-呈面心立方密堆积,Li+和M交替地填满所有的八面体空隙。从图上可知,该种画法中M3+、Li+的原子分数坐标为:(0,0,0),(1/2,1/2,0),(1/2,0,1/2),(0,1/2,1/2)——即交替地分布于顶点和面心;而O2-的原子分数坐标为(1/2,0,0),(0,1/2,0),(0,0,1/2),(1/2,1/2,1/2),即棱心和体心的位置。因此坐标发生移,将O2-平移到晶胞顶点的位置后,M3+、Li+交替位于晶胞的棱心和体心的位置。如下图所示:

⑶Li+嵌入石墨的层状结构之间,碳原子与锂离子之间发生一定的静电作用,石墨体积稍微变大。最大程度地嵌入时,锂离子呈简单六方晶体,晶胞结构示意图如下:

⑷锂是活泼金属,因此易与电解质反应,形成锂的枝状晶体,导致电池被侵蚀或爆炸。能够代替石墨的材料至少要满足这几个条件:一是不能锂发生化学反应,二最好是层状结构,以便嵌入Li+,三是能导电。所以还可用低熔点的金属如Si,Bi,Pb,Sn,Cd等与锂掺杂形成金属合金,或用电解质如液体电解质LiPF6,LiBF6,LiAsF6及LiOSO2CF3(有机溶剂不能含水),以及固体电解质等。

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目