题目内容
由烷基镁热分解制得镁的氢化物。实验测定,该氢化物中氢的质量分数为7.6%,氢的密度为0.101 g cm?3,镁和氢的核间距为194.8 pm。已知氢原子的共价半径为37pm,Mg2+ 的离子半径为72 pm。
⑴ 写出该氢化物中氢的存在形式,并简述理由。
⑵ 将上述氢化物与金属镍在一定条件下用球磨机研磨,可制得化学式为Mg2NiH4的化合物。X-射线衍射分析表明,该化合物的立方晶胞的面心和顶点均被镍原子占据,所有镁原子的配位数都相等。推断镁原子在Mg2NiH4晶胞中的位置(写出推理过程)。
⑶ 实验测定,上述Mg2NiH4晶体的晶胞参数为646.5 pm,计算该晶体中镁和镍的核间距。已知镁和镍的原子半径分别为159.9 pm和124.6 pm。
⑷ 若以材料中氢的密度与液态氢密度之比定义储氢材料的储氢能力,计算Mg2NiH4的储氢能力(假定氢可全部放出;液氢的密度为0.0708 g·cm-3)。
⑴ 写出该氢化物中氢的存在形式,并简述理由。
⑵ 将上述氢化物与金属镍在一定条件下用球磨机研磨,可制得化学式为Mg2NiH4的化合物。X-射线衍射分析表明,该化合物的立方晶胞的面心和顶点均被镍原子占据,所有镁原子的配位数都相等。推断镁原子在Mg2NiH4晶胞中的位置(写出推理过程)。
⑶ 实验测定,上述Mg2NiH4晶体的晶胞参数为646.5 pm,计算该晶体中镁和镍的核间距。已知镁和镍的原子半径分别为159.9 pm和124.6 pm。
⑷ 若以材料中氢的密度与液态氢密度之比定义储氢材料的储氢能力,计算Mg2NiH4的储氢能力(假定氢可全部放出;液氢的密度为0.0708 g·cm-3)。
⑴H-
镁-氢间距离为194.8 pm,Mg2+离子半径为72 pm,则氢的半径为194.8 pm-72 pm =123 pm。此值远大于氢原子的共价半径, 这说明H原子以H? 离子的形式存在。
⑵Mg原子与Ni原子数之比为2 : 1,故每个晶胞中含8个镁原子。所有镁原子的配位数相等,它们只能填入由镍原子形成的四面体空隙。
镁原子的位置用下列坐标参数:
1/4, 1/4, 1/4; 1/4, 1/4, 3/4; 3/4, 3/4, 1/4; 3/4, 3/4, 3/4;
1/4, 3/4, 1/4; 1/4, 3/4, 3/4; 3/4, 1/4, 1/4; 3/4, 1/4, 3/4。
⑶镁镍间的距离为

不能用原子半径相加计算镁-镍间的距离。
⑷储氢能力=晶体的密度×氢的质量分数÷液氢密度

= 1.40
=" 1.4"
镁-氢间距离为194.8 pm,Mg2+离子半径为72 pm,则氢的半径为194.8 pm-72 pm =123 pm。此值远大于氢原子的共价半径, 这说明H原子以H? 离子的形式存在。
⑵Mg原子与Ni原子数之比为2 : 1,故每个晶胞中含8个镁原子。所有镁原子的配位数相等,它们只能填入由镍原子形成的四面体空隙。
镁原子的位置用下列坐标参数:
1/4, 1/4, 1/4; 1/4, 1/4, 3/4; 3/4, 3/4, 1/4; 3/4, 3/4, 3/4;
1/4, 3/4, 1/4; 1/4, 3/4, 3/4; 3/4, 1/4, 1/4; 3/4, 1/4, 3/4。
⑶镁镍间的距离为

不能用原子半径相加计算镁-镍间的距离。
⑷储氢能力=晶体的密度×氢的质量分数÷液氢密度

= 1.40
=" 1.4"
⑴镁-氢间距离为194.8 pm,Mg2+离子半径为72 pm,则氢的半径为194.8 pm-72 pm =123 pm。此值远大于氢原子的共价半径, 这说明H原子以H? 离子的形式存在。
⑵该晶体中,Ni原子按面心立方方式排列,该结构中原子数∶四面体空隙数∶八面体空隙数=1∶2∶1,从Ni和Mg的配位数可知,Mg填入四面体空隙中。
⑶直接利用空间中两点间的距离计算公式,计算(0,0,0)和(1/4,1/4,1/4)两点间的距离。
⑷本题的核心在于检查学生晶体密度的计算公式的掌握及熟练程度,将数据带入公式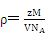 ,求得晶体的密度,乘于氢的质量分数求得储氢密度,最后与液氢的密度相比,求该材料的储氢能力。
,求得晶体的密度,乘于氢的质量分数求得储氢密度,最后与液氢的密度相比,求该材料的储氢能力。
⑵该晶体中,Ni原子按面心立方方式排列,该结构中原子数∶四面体空隙数∶八面体空隙数=1∶2∶1,从Ni和Mg的配位数可知,Mg填入四面体空隙中。
⑶直接利用空间中两点间的距离计算公式,计算(0,0,0)和(1/4,1/4,1/4)两点间的距离。
⑷本题的核心在于检查学生晶体密度的计算公式的掌握及熟练程度,将数据带入公式
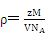 ,求得晶体的密度,乘于氢的质量分数求得储氢密度,最后与液氢的密度相比,求该材料的储氢能力。
,求得晶体的密度,乘于氢的质量分数求得储氢密度,最后与液氢的密度相比,求该材料的储氢能力。
练习册系列答案
相关题目

 HBr+HIO,下列有关IBr的叙述中,错误的是( )?
HBr+HIO,下列有关IBr的叙述中,错误的是( )?