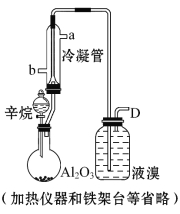
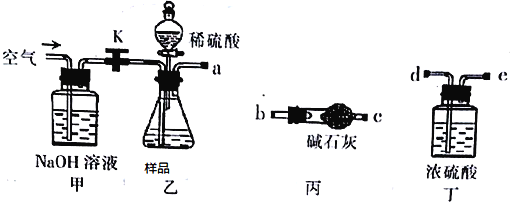
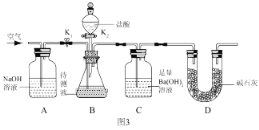
题目内容
【题目】X、Y、Z、W是元素周期表前四周期中原子序数依次增大的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X的某种氢化物能使湿润的红色石蕊试纸变蓝 |
Y | Y的一种核素质量数为24.中子数为12 |
Z | Z的单质是良好的半导体材料,广泛应用于光电信息领域 |
W | W的最高价氧化物对应水化物是一种不溶于水的蓝色固体 |
回答下列问题:
(1)Y在元素周期表中的位置是________;X、Z的简单气态氢化物稳定性较弱的是____(填化学式)。
(2)X的一种氢化物X2H4的分子中极性键和非极性键数目比为_______;Y的氯化物电子式为________。
(3)W的氧化物(W2O)跟X的最高价氧化物对应的水化物反应生成XO的离子方程式为_______。
【答案】 第三周期、第IIA族 SiH4 4:1 ![]() 3Cu2O + 2NO3- +14H+=6Cu2++ 2NO↑+ 7H2O
3Cu2O + 2NO3- +14H+=6Cu2++ 2NO↑+ 7H2O
【解析】试题分析:由题中信息可知,X、Y、Z、W分别为N、Mg、Si、Cu等元素。
(1)Y在元素周期表中的位置是第三周期、第IIA族;N的非金属性比Si强,故其简单气态氢化物稳定性较弱的是SiH4。
(2) N2H4的分子中极性键和非极性键数目比为4:1;Y的氯化物电子式为![]() 。
。
(3) Cu2O)跟HNO3反应生成NO的离子方程式为3Cu2O + 2NO3- +14H+=6Cu2++ 2NO↑+ 7H2O。

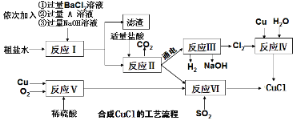
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如图所示:
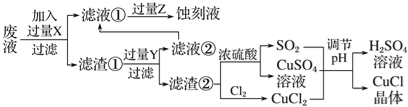
根据以上信息回答下列问题:
(1)写出生产过程中X________;Y________(填化学式)。
(2)析出的CuCl晶体不用水而用无水乙醇洗涤的目的是________________________;生产过程中调节溶液的pH不能过大的原因是________________________。
(3)写出生成CuCl的化学方程式:__________________________________。
(4)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是_________________。
(5)已知:常温下Ksp(CuCl)=1.6×10-7,Ksp(CuI)=1.2×10-12,现向CuCl饱和溶液中加入NaI固体至c(I-)=0.1mol/L,此时溶液中c(Cu+)/c(Cl-)=________。
(6)氯化亚铜的定量分析
①称取样品0.25 g置于已放入10 mL过量的FeCl3溶液的锥形瓶中,不断摇动。
②待样品溶解后,加水50 mL,邻菲罗啉指示剂2滴。
③立即用0.10 mol·L-1硫酸铈标准溶液滴定至终点,同时做空白实验一次。
已知:
CuCl+FeCl3===CuCl2+FeCl2;Fe2++Ce4+===Fe3++Ce3+。
如此再重复2次测得:
1 | 2 | 3 | |
空白实验消耗硫酸铈 标准溶液的体积/mL | 0.75 | 0.50 | 0.80 |
0.25 g样品消耗硫酸铈 标准溶液的体积/mL | 24.65 | 25.75 | 24.90 |
④数据处理:计算得CuCl的纯度为_________(平行实验结果相差不能超过0.3%)。