题目内容
【题目】某研究性课题小组对氢氧化钠溶液和稀盐酸中和反应的有关问题,进行了如下探究:
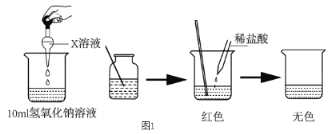
I:(1)甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了图 1所示实验,则 X溶液是_____________。
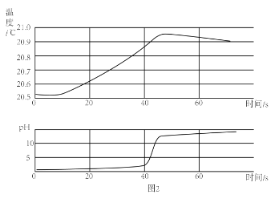
(2)乙同学用传感器探究稀 NaOH 溶液与稀盐酸反应过程中温度和 pH的变化。测定结果如图2所示。通过分析可知,稀 NaOH 溶液与稀盐酸反应会__________(放出”或“吸收”)热量。30s 时,溶液中的溶质为 _____________(写化学式)
II:丙同学为了验证上述实验,也将盐酸滴入某氢氧化钠溶液中,发现有气泡产生,他认为该氢氧化钠溶液已经变质,变质原因用化学方程式可表示为 ____________________。
III:为了测定该氢氧化钠溶液中碳酸钠的质量分数,丙同学设计了如图3所示的实验装置。已知分液漏斗中装有 10%的稀盐酸,装置内试剂均足量。
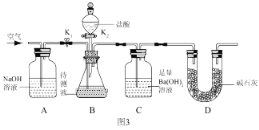
(实验步骤)
①按如图 3 连接好装置后,并检查装置气密性;
②关闭 K1 和 K2,向 B 装置中加入 100.0g该氢氧化钠溶液样品(忽略原装置内空气中CO2对实验的影响);
③打开 K2,向锥形瓶内滴加盐酸,直到 B 中不再产生气泡为止;
④打开 K1 关闭 K2,通入一段时间空气,至装置 C 中不再产生沉淀为止;
⑤将装置 C 中的固液混合物过滤、洗涤、烘干后称得固体质量为 5.0g。
(实验分析及数据处理)
①A 装置的作用是 ____________________。
②若缺少步骤④,则测定结果将 __________(填“偏大”、“偏小”或“不变”)。
③利用实验数据,计算该氢氧化钠溶液中碳酸钠的质量分数为 5.3%。
(实验反思)
下列各项措施中,能提高测定准确度的是 __________(填字母)
A.缓缓滴加稀盐酸
B.在装置 A、B 之间增加盛有浓硫酸的洗气瓶
C.在装置 B、C 之间增加盛有饱和 NaHCO3 的洗气瓶
【答案】酚酞溶液放出HCl、NaCl2NaOH+CO2 =====Na2CO3+H2O除去空气中的二氧化碳,减小实验误差偏小
【解析】
(1)加入试剂X后,氢氧化钠溶液显示红色,故加入的是酚酞。
(2)根据温度和时间图像判断该反应的吸放热情况;根据pH与时间图像判断反应后溶液的溶质。
(3)氢氧化钠与空气中的二氧化碳反应生成碳酸钠而发生变质。
(4)①利用空气排净装置内的二氧化碳和水蒸气等气体,以减小实验误差,空气中的二氧化碳用氢氧化钠溶液预先除去。
②反应结束后,利用空气把反应产生的二氧化碳气体全部被氢氧化钡溶液吸收,减少误差。
③能够减小实验误差的操作,都可以提高碳酸钠的纯度的测定。
I:(1)根据实验现象可知,向氢氧化钠溶液中滴加酚酞溶液,溶液变红,加入盐酸后,酸碱中和,碱性减弱,溶液红色褪去,因此所加的试剂为酚酞;正确答案:酚酞溶液。
(2)根据温度和时间的图像变化关系可知,酸碱中和反应为放热反应;根据溶液pH 与时间图像可知,30s 时,溶液的pH小于5,显酸性,溶质为HCl和NaCl;正确答案:HCl和NaCl。
II:(2)部分氢氧化钠与空气中的二氧化碳反应生成碳酸钠,加入盐酸后,碳酸钠与盐酸反应产生气泡;因此氢氧化钠溶液变质的反应为:2NaOH+CO2 =====Na2CO3+H2O;正确答案:2NaOH+CO2 =====Na2CO3+H2O。
III:(3)①A 装置装有氢氧化钠溶液,能够吸收空气中的二氧化碳气体,以免对二氧化碳气体的测定带来影响;正确答案:除去空气中的二氧化碳,减小实验误差。
②若缺少步骤④,反应产生的二氧化碳气体不能被氢氧化钡溶液完全吸收,造成测定碳酸钠的含量降低,碳酸钠的百分含量偏小;正确答案:偏小。
③A. 缓缓滴加稀盐酸时,能使反应生成的二氧化碳全部被氢氧化钡溶液吸收,从而提高测定的准确度,A正确。
B.在装置A、B之间是否增加盛有浓硫酸的洗气瓶,都不影响二氧化碳的质量,该选项不能提高碳酸钠的质量分数测定准确度,B错误。
C.在装置B、C之间增加盛有饱和NaHCO3溶液的洗气瓶时,二氧化碳中混有的氯化氢气体能和碳酸氢钠反应生成二氧化碳,氢氧化钡吸收二氧化碳的量增多,从而导致计算出的碳酸钠质量分数偏大,该选项不能提高碳酸钠的质量分数测定准确度,C错误。正确选项A。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】X、Y、Z、W是元素周期表前四周期中原子序数依次增大的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X的某种氢化物能使湿润的红色石蕊试纸变蓝 |
Y | Y的一种核素质量数为24.中子数为12 |
Z | Z的单质是良好的半导体材料,广泛应用于光电信息领域 |
W | W的最高价氧化物对应水化物是一种不溶于水的蓝色固体 |
回答下列问题:
(1)Y在元素周期表中的位置是________;X、Z的简单气态氢化物稳定性较弱的是____(填化学式)。
(2)X的一种氢化物X2H4的分子中极性键和非极性键数目比为_______;Y的氯化物电子式为________。
(3)W的氧化物(W2O)跟X的最高价氧化物对应的水化物反应生成XO的离子方程式为_______。
