题目内容
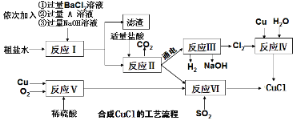
【题目】氯化亚铜(CuCl)是一种白色粉末,不溶于水、乙醇(标准状况下沸点是78.2℃)及稀硫酸,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用于有机合成工业中的催化剂。以粗盐水(含氯化钙、硫酸镁等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺流程如下:
(1)A溶液中溶质的化学式是__________ ;
(2)写出反应V的化学方程式 _______________ ;
(3)反应VI的化学方程式是:2NaCl+2CuSO4+SO2+2H2O=2CuCl↓+2H2SO4+Na2SO4,反应中化合价升高的元素是___;
(4)本工艺中可循环利用的物质是NaOH和_____;
(5)反应VI后,过滤得到的CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却密封包装即得产品。真空干燥的目的是_______________。
【答案】Na2CO3 2Cu+O2 + 2H2SO4=2CuSO4 +2H2O硫硫酸防止氯化亚铜被氧化(加快乙醇和水的蒸发)
【解析】
由流程分析可知,粗盐水加入过量氯化钡溶液沉淀硫酸根离子,加入过量氢氧化钠沉淀镁离子,最后加入碳酸钠沉淀过量的钡离子、钙离子,过滤后加入盐酸除去过量的碳酸钠,得到较纯净的氯化钠溶液;电解氯化钠溶液可以得到氢氧化钠溶液、氢气和氯气;利用生成的氯气和过量铜及水反应生成氯化亚铜,也可以利用铜、氧气、稀硫酸反应生成硫酸铜,通入二氧化硫还原得到氯化亚铜,这个反应过程中硫酸、氢氧化钠可以循环使用;根据题给相关氯化亚铜信息可知,CuCl具有还原性,可以被空气氧化,因此用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却密封包装即得产品。
(1)反应Ⅰ中A为Na2CO3溶液,可除去粗盐溶液中Ca2+和除去硫酸根离子所加的过量的Ba2+;本题正确答案:Na2CO3。
(2)根据流程可知,在硫酸溶液中铜与氧气反应生成硫酸铜和水,反应的方程式为2Cu+O2+4H2SO4=2CuSO4+2H2O;因此,本题正确答案是:2Cu+O2+4H2SO4=2CuSO4+2H2O。
(3)根据反应2NaCl+2CuSO4+SO2+2H2O=2CuCl↓+2H2SO4+Na2SO4可知,硫元素的化合价由+4价变为+6价,化合价升高;正确答案:硫。
(4)从流程过程可知,氢氧化钠用来除去镁离子,电解饱和食盐水又生成氢氧化钠;反应V消耗硫酸,反应VI生成硫酸,因此本工艺中可循环利用的物质是NaOH和硫酸;正确答案:硫酸。
(5)根据题给信息可知,CuCl沉淀,可用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,这样可以加快乙醇和水的蒸发,防止CuCl被空气氧化;因此,本题正确答案是:加快乙醇和水的蒸发,防止CuCl被空气氧化。

【题目】X、Y、Z、W是元素周期表前四周期中原子序数依次增大的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X的某种氢化物能使湿润的红色石蕊试纸变蓝 |
Y | Y的一种核素质量数为24.中子数为12 |
Z | Z的单质是良好的半导体材料,广泛应用于光电信息领域 |
W | W的最高价氧化物对应水化物是一种不溶于水的蓝色固体 |
回答下列问题:
(1)Y在元素周期表中的位置是________;X、Z的简单气态氢化物稳定性较弱的是____(填化学式)。
(2)X的一种氢化物X2H4的分子中极性键和非极性键数目比为_______;Y的氯化物电子式为________。
(3)W的氧化物(W2O)跟X的最高价氧化物对应的水化物反应生成XO的离子方程式为_______。
