题目内容
11.若称取10.5g 纯净的NaHCO3固体,加热一段时间后,剩余固体的质量为7.92g.把剩余的固体全部加入到100mL2mol•L-1的盐酸中充分反应.求:溶液中剩余的盐酸的物质的量浓度?(设溶液的体积变化忽略不计).(写出解题过程)
分析 根据n=$\frac{m}{M}$计算n(NaHCO3),NaHCO3最终完全转变成NaCl,消耗盐酸的物质的量等于NaHCO3物质的量,再计算剩余HCl物质的量,根据c=$\frac{n}{V}$计算溶液中剩余的盐酸的物质的量浓度.
解答 解:n(NaHCO3)=10.5g/84g.mol-1=0.125 mol,
NaHCO3最终完全转变成NaCl,消耗盐酸的物质的量等于NaHCO3物质的量,
则n(HCl)剩余=n(HCl)-n(NaHCO3)=0.1L×2mol•L-1-0.125 mol=0.075 mol
故c(HCl)剩余=0.075 mol/0.1L=0.75 mol•L-1
答:溶液中剩余的盐酸的物质的量浓度为0.75 mol•L-1.
点评 本题考查化学方程式计算,注意利用守恒发生计算消耗HCl物质的量,难度不大.

练习册系列答案
相关题目
3.下列金属中用电解方法进行冶炼的是( )
| A. | 铝 | B. | 铜 | C. | 银 | D. | 铁 |
2.氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2+6C+2N2$\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO.下列对该反应的说法正确的是( )
| A. | 该反应的氧化剂是SiO2和N2 | |
| B. | 该反应的还原产物为CO | |
| C. | 该反应中氧化剂和还原剂质量比为9:7 | |
| D. | 生成1mol Si3N4时共转移12mol电子 |
6.碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分MnO2)和黄铁矿
(主要成分FeS2)为主要原料制备碳酸锰(MnCO3难溶,分解温度较高)的一种工艺流程如下:
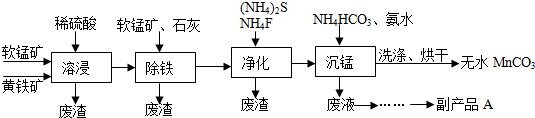
已知:几种金属离子沉淀的pH如下表:
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,可以采取的措施有ABC
A.适当升高温度 B.搅拌 C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:
2FeS2+15MnO2+28H+=2Fe3++15Mn2++4SO42ˉ+14H2O
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质.
请写出除去Cu2+的离子方程式:Cu2++S2ˉ=CuS↓;
若测得滤液中c(Fˉ)=0.01mol•Lˉ1,则滤液中残留c(Ca2+)=1.5×10-6mol•Lˉ1.
[已知:Ksp(CaF2)=1.5×10ˉ10]
(4)除铁工序中,先加入适量的软锰矿,其作用是使残余Fe2+转化为Fe3+,再加入石灰调节溶液的pH的范围为3.7~5.2.
(5)副产品A的主要成分是(NH4)2SO4.
(主要成分FeS2)为主要原料制备碳酸锰(MnCO3难溶,分解温度较高)的一种工艺流程如下:

已知:几种金属离子沉淀的pH如下表:
| Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 7.8 | 10.4 |
(1)为了提高溶浸工序中原料的浸出效率,可以采取的措施有ABC
A.适当升高温度 B.搅拌 C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:
2FeS2+15MnO2+28H+=2Fe3++15Mn2++4SO42ˉ+14H2O
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质.
请写出除去Cu2+的离子方程式:Cu2++S2ˉ=CuS↓;
若测得滤液中c(Fˉ)=0.01mol•Lˉ1,则滤液中残留c(Ca2+)=1.5×10-6mol•Lˉ1.
[已知:Ksp(CaF2)=1.5×10ˉ10]
(4)除铁工序中,先加入适量的软锰矿,其作用是使残余Fe2+转化为Fe3+,再加入石灰调节溶液的pH的范围为3.7~5.2.
(5)副产品A的主要成分是(NH4)2SO4.
1.下列反应的离子方程式正确的是( )
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 氢氧化钡溶液跟稀硫酸反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 过氧化钠与水反应:2Na2O2+2H2O═4Na++4OH-+O2↑ |
 (1)下列物质中,①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融NaOH ⑥稀硫酸 ⑦乙酸,属于强电解质且能导电的是⑤(填序号)
(1)下列物质中,①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融NaOH ⑥稀硫酸 ⑦乙酸,属于强电解质且能导电的是⑤(填序号)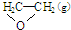 ),但是伴随副反应
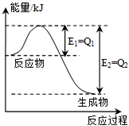
),但是伴随副反应 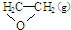 △H1
△H1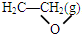 +$\frac{5}{2}$O2(g)=2 CO2 (g)+2 H2O(g)△H=△H2-△H1.
+$\frac{5}{2}$O2(g)=2 CO2 (g)+2 H2O(g)△H=△H2-△H1.