题目内容
16.工业上常常利用乙烯通过反应 I来生产环氧乙烷 (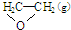 ),但是伴随副反应
),但是伴随副反应 I.$\frac{1}{2}$IC2H4(g)+O2(g)→
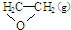 △H1
△H1II. C2H4(g)+3O2(g)→2CO2(g)+2H2O(g)△H2
①写出环氧乙烷充分燃烧的热化学反应方程式:
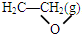 +$\frac{5}{2}$O2(g)=2 CO2 (g)+2 H2O(g)△H=△H2-△H1.
+$\frac{5}{2}$O2(g)=2 CO2 (g)+2 H2O(g)△H=△H2-△H1.②工业生产中,可通过某一措施来加快反应①而对反应②影响较小,从而提高环氧乙烷 的生产效率.工业生产采取的这种措施是C.
A.升高反应体系的温度 B.增大体系中氧气的浓度
C.使用合适的催化剂 D.降低反应体系的压强
③已知C=C、O=O、C-C键能分别为a kJ•mol-1、b kJ•mol-1、c kJ•mol-1,则环氧乙烷中C-O键能为$\frac{a+\frac{b}{2}-c-△H{\;}_{1}}{2}$kJ•mol-1.
分析 ①根据盖斯定律由①②两个热化学方程式构造环氧乙烷燃烧反应的化学方程式(注明状态),即可获得焓变;
②升高温度、增大体系中氧气的浓度对于①②的化学反应速率都可以加快,降低反应体系的压强,对①②化学反应速率都可以减小,催化剂具有选择性,使用合适的催化剂可达到目的;
③据△H1=反应物的键能之和-生成物的键能之和计算.
解答 解:①已知:①C2H4(g)+$\frac{1}{2}$O2(g)→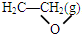 ;△H1
;△H1
②C2H4(g)+3O2(g)→2CO2(g)+2H2O(g);△H2
由盖斯定律可知:②-①得: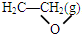 +$\frac{5}{2}$O2(g)=2 CO2 (g)+2 H2O(g)△H=△H2-△H1,
+$\frac{5}{2}$O2(g)=2 CO2 (g)+2 H2O(g)△H=△H2-△H1,
故答案为: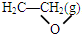 +$\frac{5}{2}$O2(g)=2 CO2 (g)+2 H2O(g)△H=△H2-△H1;
+$\frac{5}{2}$O2(g)=2 CO2 (g)+2 H2O(g)△H=△H2-△H1;
②升高温度、增大体系中氧气的浓度对于①②的化学反应速率都可以加快,降低反应体系的压强,对①②化学反应速率都可以减小,催化剂具有选择性,使用合适的催化剂可达到目的,
故选C;
③△H1=反应物的键能之和-生成物的键能之和=(a+$\frac{b}{2}$) kJ•mol-1 -(ckJ•mol-1 +2×EC-O),(注意:反应物和生成物中均有4molC-H,相互抵消),
所以EC-O=$\frac{a+\frac{b}{2}-c-△H{\;}_{1}}{2}$kJ•mol-1;
故答案为:$\frac{a+\frac{b}{2}-c-△H{\;}_{1}}{2}$.
点评 本题考查了盖斯定律、平衡移动原理及焓变的计算等,难度中等.

练习册系列答案
相关题目
8.下列表述正确的是( )
| A. | 某离子第三层上和第二层上的电子数均为第一层的4倍 | |
| B. | Cl-的结构示意图: | |
| C. | 某物质的焰色反应为黄色,某物质一定为钠的化合物 | |
| D. | 14C和14N的质量数相等,互称为同位素 |
7.实验室保存下列化学试剂的方法正确的是( )
| A. | 水玻璃保存在带磨口玻璃塞的试剂瓶中 | |
| B. | 少量金属钠可保存在煤油中,大量的金属钠可保存在液体石蜡中 | |
| C. | 氢氟酸保存在磨口试剂瓶中 | |
| D. | 液溴密封盛放在无色试剂瓶中,并在液面上放一层水 |
4.对于常温下PH为2的盐酸,下列叙述正确的是( )
| A. | c(H+)=c(Cl-)+c(OH-) | |
| B. | 由水电离出的c(H+)=1.0×10ˉ 2 mol•Lˉ1 | |
| C. | 与等体积PH=12的氨水混合后所得溶液显中性 | |
| D. | 与等体积0.01 mol•Lˉ1CH3COONa溶液混合后所得溶液中:c(Cl-)=c(CH3COO-) |
1.已知常温下在溶液中可发生如下两个离子反应:
①Ge4++Fe2+═Fe3++Ge3+
②Sn2++2Fe3+═2Fe2++Sn4+
由此可以确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是( )
①Ge4++Fe2+═Fe3++Ge3+
②Sn2++2Fe3+═2Fe2++Sn4+
由此可以确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是( )
| A. | Sn2+、Fe2+、Ge3+ | B. | Sn2+、Ge3+、Fe2+ | C. | Ge3+、Fe2+、Sn2+ | D. | Fe2+、Sn2+、Ge3+ |
8.下列各组溶液间的反应,可用同一个离子方程式表示的是( )
| A. | 盐酸与碳酸钠,盐酸与碳酸钙 | |
| B. | 氯化钡与硫酸钠,氢氧化钡与硫酸镁 | |
| C. | 氢氧化钠与盐酸,氢氧化钠与醋酸 | |
| D. | 硝酸钙与碳酸钠,氯化钙与碳酸钾 |
5.200ml Fe2(SO4)3溶液中Fe3+的浓度5mol/L,溶液中SO42-的物质的量浓度是( )
| A. | 5mol/L | B. | 7.5 mol/L | C. | 10 mol/L | D. | 2.5 mol/L |
6.质量都为4.2g的A气体和B气体,在标准状况下的体积分别为2.94L和3.36 L,则这两种气体的摩尔质量之比为( )
| A. | 1:1 | B. | 15:13 | C. | 7:8 | D. | 8:7 |