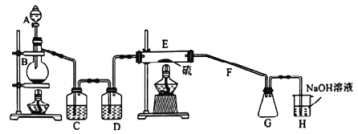
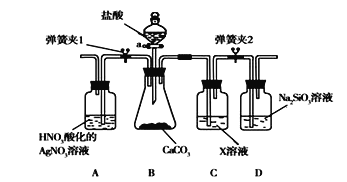
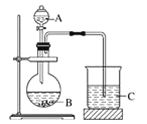
题目内容
【题目】如表是元素周期表的一部分,参照元素在表中的位置,请按要求回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)用序号回答:
①—元素中,_________形成的气态氢化物最稳定;化学性质最不活泼原子是_______;_______的最高价氧化物的水化物呈两性;用中文“![]() ”(ào)命名的第118号元素与_____同一族。
”(ào)命名的第118号元素与_____同一族。
(2)用“>”“<”回答:
原子半径:⑥___________⑦;离子半径:⑤___________⑧。
(3)用化学用语回答:
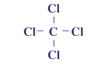
⑥的原子结构示意图是______________;②和形成的化合物的结构式是___________;
⑩的气态氢化物的化学式是____________;的最高价含氧酸的化学式是____________。
(4)①和④两种元素的原子按2:1组成的常见化合物的电子式为________________。①和③两种元素的原子按5:1组成化合物,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,它的电子式为___________________。
(5)⑦⑧两元素相比较,金属性较强的是_________________(填名称),可以验证该结论的实验是_____________(填字母)。
A 将在空气中放置已久的这两种元素的块状单质分别放入热水中
B 将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
C 将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
D 比较这两种元素的气态氢化物的稳定性
【答案】⑤ ⑧ > > 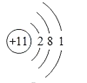
 PH3 HClO4
PH3 HClO4 ![]()
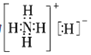 镁 BC
镁 BC
【解析】
根据所给元素在周期表中位置,推出12种元素分别为H、C、N、O、F、Na、Mg、Al、Si、P、Cl、Ar,然后逐题分析;
(1)非金属性越强,其气态氢化物稳定性越强,同周期从左向右非金属性增强(稀有气体除外),同主族从上到下非金属性减弱,即所给元素中非金属性增强的是F,即气态氢化物稳定性最强的是⑤;化学性质最不活泼是稀有气体,即;氢氧化物表现两性,指的是氢氧化铝,即⑧;按照核外电子排布的规律,118号元素核外电子示意图为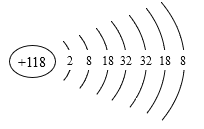 ,即118号元素位于第七周期0族,118号元素与属于同主族;
,即118号元素位于第七周期0族,118号元素与属于同主族;
(2)同周期从左向右原子半径减小,即⑥>⑦,⑤和⑧离子分别是F-、Al3+,它们核外电子排布相同,即离子半径⑤>⑧;
(3)⑥为Na,11号元素,即原子结构示意图为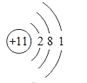 ;②和形成的化合物是CCl4,其其结构式为
;②和形成的化合物是CCl4,其其结构式为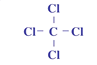 ;⑩的气态氢化物是PH3;的最高价含氧酸是HClO4;
;⑩的气态氢化物是PH3;的最高价含氧酸是HClO4;
(4)H和O形成的化合物是H2O和H2O2,原子按2:1组成,即为H2O,其电子式为![]() ;H和N两种元素的原子按5:1组成化合物,该化合物化学式为NH5,它的所有原子的最外层都符合相应稀有气体的最外层电子层结构,即电子式为
;H和N两种元素的原子按5:1组成化合物,该化合物化学式为NH5,它的所有原子的最外层都符合相应稀有气体的最外层电子层结构,即电子式为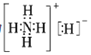 ;
;
(5)同周期从左向右金属性减弱,即Mg和Al金属性较强的是Mg,
A、在空气防止已久,金属表面产生氧化膜,MgO和Al2O3不与热水反应,不能判断金属性强弱,故A不符合题意;
B、观察与盐酸反应的速率,金属性强的与盐酸反应速率快,能够判断金属性强弱,故B符合题意;
C、将形状、大小相同这两种元素的单质分别和热水反应,并滴入酚酞,溶液碱性越强,说明金属性越强,故C符合题意;
D、二者都是金属,没有气态氢化物,不能根据氢化物的稳定性判断金属性强弱,故D不符合题意。

【题目】利用熔融碱焙烧工艺可从铝热法生产金属铬的铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,为实现铬和铝的再生利用。其工作流程如下:
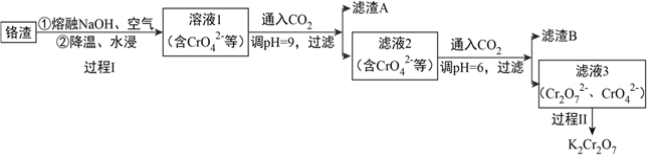
(1)铝热法冶炼金属铬,是利用了金属铝的__________(填“氧化性”或“还原性”)。
(2)溶液1中的阴离子有CrO42-、______、_______。
(3)过程I,在Cr2O3参与的反应中,若生成0.4molCrO42-,消耗氧化剂的物质的量是__________。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是____________________。
②滤渣B受热分解所得物质的参与循环利用,B是__________。
③已知:2CrO42-+2H+ ![]() Cr2O72-+H2O K=4.0×1014
Cr2O72-+H2O K=4.0×1014
滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是__________mol/L。
(5)过程II的目的是得到K2Cr2O7粗品。
不同温度下化合物的溶解度(g/100gH2O)
化合物名称 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 |
K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
结合表中数据分析,过程II的操作是:__________________________,过滤,得到K2Cr2O7粗品。