题目内容
【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,A与E同主族,E的单质是良好的半导体材料,D+核外电子排布与C2-相同。试回答(涉及到的物质均用化学式作答):
(1)元素E在元素周期表中的位置是___________________。
(2)与元素D的简单离子所含电子数和质子数都相同的微粒是____________(写一个即可)。
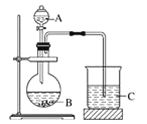
(3)A、B和E最高价氧化物对应的水化物中,酸性最弱的是_________________(写化学式)。若用如图中装置验证这三种酸的酸性强弱,则在装置A中应加入______(写化学式),烧杯C观察到的实验现象是_____________________________。该实验装置存在不足,影响到实验目的的达成,改进方法是_____________。
(4)B的最高价氧化物对应的水化物的稀溶液与B的气态氢化物反应的化学方程式为_____________
(5)用电子式表示D2C的形成过程:_______________________________________________
【答案】第3周期ⅣA族 H3O+或NH4+ H2SiO3或H4SiO4 HNO3 生成白色沉淀 在B和C之间增加一个装有饱和碳酸氢钠溶液的洗气瓶 HNO3 + NH3 === NH4NO3 ![]()
【解析】
E的单质是良好的半导体材料,即E为Si,A与E同主族,即A为C,五种元素原子序数依次增大,且都为短周期主族元素,根据D+和C2-核外电子排布相同,即D为Na,C为O,B为N,然后进行分析;
E的单质是良好的半导体材料,即E为Si,A与E同主族,即A为C,五种元素原子序数依次增大,且都为短周期主族元素,根据D+和C2-核外电子排布相同,即D为Na,C为O,B为N,
(1)Si位于周期表中第三周期IVA族;
(2)D+为Na+,质子数为11,电子数为10,具有相同电子数和质子数的微粒是H3O+、NH4+等;
(3)三种元素最高价氧化物对应的水化物分别是H2CO3、HNO3、H2SiO3,酸性强弱顺序是HNO3>H2CO3>H2SiO3,即酸性最弱的是H2SiO3或H4SiO4;根据三种酸的强弱顺序,A为硝酸,B为碳酸钠或碳酸氢钠,C为硅酸钠,烧瓶中发生2H++CO32-=CO2↑+H2O或H++HCO3-=H2O+CO2↑,C中发生反应:CO2+SiO32-+H2O=H2SiO3↓+CO32-或2CO2+SiO32-+2H2O=H2SiO3↓+2HCO3-,C中出现白色沉淀;因为HNO3挥发,B中产生CO2中混有HNO3,干扰CO2与Na2SiO3的反应,因此在B和C之间增加一个装有饱和碳酸氢钠溶液的洗气瓶;
(4)B的最高价氧化物对应水化物是HNO3,B的气态氢化物NH3,两者发生化学方程式为NH3+HNO3=NH4NO3;
(5)D2C为Na2O,属于离子化合物,其形成过程:![]() 。
。

【题目】如表是元素周期表的一部分,参照元素在表中的位置,请按要求回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)用序号回答:
①—元素中,_________形成的气态氢化物最稳定;化学性质最不活泼原子是_______;_______的最高价氧化物的水化物呈两性;用中文“![]() ”(ào)命名的第118号元素与_____同一族。
”(ào)命名的第118号元素与_____同一族。
(2)用“>”“<”回答:
原子半径:⑥___________⑦;离子半径:⑤___________⑧。
(3)用化学用语回答:
⑥的原子结构示意图是______________;②和形成的化合物的结构式是___________;
⑩的气态氢化物的化学式是____________;的最高价含氧酸的化学式是____________。
(4)①和④两种元素的原子按2:1组成的常见化合物的电子式为________________。①和③两种元素的原子按5:1组成化合物,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,它的电子式为___________________。
(5)⑦⑧两元素相比较,金属性较强的是_________________(填名称),可以验证该结论的实验是_____________(填字母)。
A 将在空气中放置已久的这两种元素的块状单质分别放入热水中
B 将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
C 将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
D 比较这两种元素的气态氢化物的稳定性
【题目】用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称量好的2.0 g烧碱样品配成100mL待测液,需要的主要玻璃仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有_______、________________。
(2)用碱式滴定管量取10.00mL待测液,置于锥形瓶中,同时滴加1-2滴指示剂。化学上常选用的指示剂有酚酞或____________。
(3)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视__________________,直到滴定到终点,若选择酚酞作为指示剂,判断滴定终点的标志是___________________________。
(4)根据下列数据,测得c(NaOH)=________。烧碱的纯度=____________。
滴定 次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
第三次 | 10.00 | 1.00 | 24.10 |
(5)以标准的盐酸溶液滴定未知浓度的氢氧化钠溶液,下列操作引起待测液浓度偏小的是 _______________(填序号)。
①读数:滴定前平视,滴定后俯视②未用待测液润洗碱式滴定管
③用待测液润洗锥形瓶④不小心将标准液滴在锥形瓶外面
⑤滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁