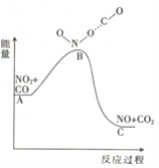
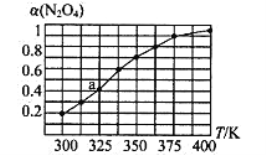
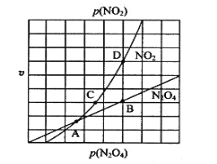
题目内容
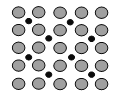
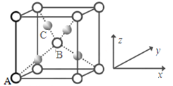
【题目】(1)诺贝尔化学奖获得者Gerhard Ertl利用光电子能谱证实:洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,图为氮原子在铁的晶面上的单层附着局部示意图(图中小的黑色球代表氮原子,大的灰色球代表铁原子)。则在图示状况下,铁颗粒表面上N/Fe原子数比值的最大值为________________。
(2)Cu与O形成的某种化合物X,其晶胞结构如下图所示。O在顶点和体心。已知X晶胞中原子坐标参数:A为(0,0,0),B为(![]() ,
,![]() ,
,![]() ),则C原子的坐标参数为___________。
),则C原子的坐标参数为___________。
物质结构用到多种模型,请结合模型完成下列问题:
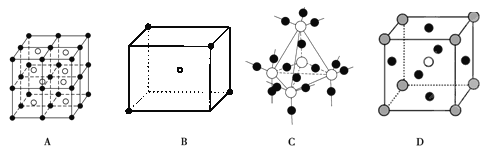
(3)D图是CaTiO3晶胞模型,同一种微粒位置相同,Ca2+位于立方体的体心,则Ti4+位于____(填顶点或面心)
(4)已知A图是CsCl晶胞模型,体心为Cs+,与其紧邻等距离的Cs+数目有___________个。
(5)某分子中原子空间位置关系如B图所示,X位于立方体的顶点,Y位于立方体中心,用X,Y表示的化学式为______________。
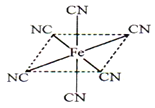
(6)铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其阴离子结构如图。写出上述沉淀溶解过程的离子方程式为___________________。
【答案】 1:2 (1/4,3/4,3/4) 顶点 6 XY2或Y2X Fe(CN)2+4CN-=[Fe(CN)6]4-
【解析】
(1)根据氮原子在铁的晶面上的单层附着局部示意图可以看出,每个铁原子周围有2个氮原子,而每个氮原子周围有4个铁原子,所以对于某个氮原子来讲,属于这个氮原子的铁原子数为4×1/2=2,所以氮原子与铁原子的个数比为1:2;
(2)根据晶胞中A和B原子的坐标参数可判断C原子的坐标参数为(1/4,3/4,3/4);
(3)D图是CaTiO3晶胞模型,同一种微粒位置相同,Ca2+位于立方体的体心,即晶胞中含有1个Ca,根据化学式可知晶胞中含有1个Ti,所以Ti4+位于顶点(8×1/8=1),面心处是O(6×1/2=3);
(4)已知A图是CsCl晶胞模型,体心为Cs+,与其紧邻等距离的Cs+位于面心处,其数目为6个。
(5)某分子中原子空间位置关系如B图所示,X位于立方体的顶点,晶胞中含有X的个数是4×1/8=1/2,Y位于立方体中心,共计是1个,则用X,Y表示的化学式为XY2或Y2X。
(6)根据阴离子结构示意图可知,阴离子的化学式是[Fe(CN)6]4-,所以上述沉淀溶解过程的离子方程式为Fe(CN)2+4CN-=[Fe(CN)6]4-。

 阅读快车系列答案
阅读快车系列答案【题目】两种短周期元素X和Y,可以组成化合物XY3,当Y的原子序数为m时,X的原子序数为
①m-4 ②m+4 ③m+8 ④m-2 ⑤m+6
A. ①②④⑤ B. ①②③⑤ C. ①②③④ D. ①②③④⑤
【题目】如表是元素周期表的一部分,参照元素在表中的位置,请按要求回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)用序号回答:
①—元素中,_________形成的气态氢化物最稳定;化学性质最不活泼原子是_______;_______的最高价氧化物的水化物呈两性;用中文“![]() ”(ào)命名的第118号元素与_____同一族。
”(ào)命名的第118号元素与_____同一族。
(2)用“>”“<”回答:
原子半径:⑥___________⑦;离子半径:⑤___________⑧。
(3)用化学用语回答:
⑥的原子结构示意图是______________;②和形成的化合物的结构式是___________;
⑩的气态氢化物的化学式是____________;的最高价含氧酸的化学式是____________。
(4)①和④两种元素的原子按2:1组成的常见化合物的电子式为________________。①和③两种元素的原子按5:1组成化合物,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,它的电子式为___________________。
(5)⑦⑧两元素相比较,金属性较强的是_________________(填名称),可以验证该结论的实验是_____________(填字母)。
A 将在空气中放置已久的这两种元素的块状单质分别放入热水中
B 将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
C 将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
D 比较这两种元素的气态氢化物的稳定性