题目内容
【题目】同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
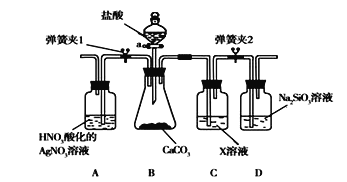
实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,关闭弹簧夹1,打开弹簧夹2当…时,关闭活塞a。
请回答:
(1)盛放盐酸的仪器名称是___________。
(2)通过步骤Ⅰ得知盐酸具有的性质是________(填字母)。
A.酸性 B.还原性 C.氧化性 D.挥发性
(3)C装置中的X是________(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写出的现象是___________________。
若通入D中的CO2足量,D中发生反应的离子方程式是______________________。
(5)碳、硅的非金属性逐渐减弱的原因是_____________________(从原子结构角度加以解释)。
【答案】分液漏斗 A、D NaHCO3 D中出现白色沉淀 SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3- 电子层数增加,半径增大,原子核对最外层电子的吸引能力减弱,非金属性减弱
【解析】
B中发生盐酸与碳酸钙的反应,生成氯化钙、水、二氧化碳;A中挥发的HCl能与硝酸银发生反应看到白色沉淀,X为碳酸氢钠溶液,与挥发的盐酸反应,可除去二氧化碳中混有的HCl;D中发生二氧化碳与硅酸钠溶液的反应,依据强酸制被弱酸原理探究得出碳的非金属性比硅强,据此分析作答。
(1)根据仪器构造可知,盛放盐酸的仪器名称是分液漏斗;
(2)A中看到白色沉淀,B装置中挥发的盐酸能与盐反应,可知盐酸具有的酸性、挥发性,故答案为:AD;
(3) C装置的作用是除HCl气体,X为碳酸氢钠溶液,与挥发的盐酸反应,可除去二氧化碳中混有的HCl,故答案为:NaHCO3;
(4)D中发生二氧化碳与硅酸钠溶液的反应,该反应为Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3,步骤Ⅱ中未写的操作和现象是关闭弹簧夹1,打开弹簧夹2,当D中出现白色沉淀后,则证明碳的非金属性大于硅,故答案为:D中出现白色沉淀;
(5)碳、硅的非金属性逐渐减弱的原因是两者位于同一主族,随着电子层数增加,半径增大,原子核对最外层电子的吸引能力减弱,非金属性减弱。

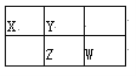
【题目】如表是元素周期表的一部分,参照元素在表中的位置,请按要求回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)用序号回答:
①—元素中,_________形成的气态氢化物最稳定;化学性质最不活泼原子是_______;_______的最高价氧化物的水化物呈两性;用中文“![]() ”(ào)命名的第118号元素与_____同一族。
”(ào)命名的第118号元素与_____同一族。
(2)用“>”“<”回答:
原子半径:⑥___________⑦;离子半径:⑤___________⑧。
(3)用化学用语回答:
⑥的原子结构示意图是______________;②和形成的化合物的结构式是___________;
⑩的气态氢化物的化学式是____________;的最高价含氧酸的化学式是____________。
(4)①和④两种元素的原子按2:1组成的常见化合物的电子式为________________。①和③两种元素的原子按5:1组成化合物,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,它的电子式为___________________。
(5)⑦⑧两元素相比较,金属性较强的是_________________(填名称),可以验证该结论的实验是_____________(填字母)。
A 将在空气中放置已久的这两种元素的块状单质分别放入热水中
B 将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
C 将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
D 比较这两种元素的气态氢化物的稳定性