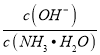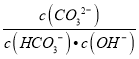题目内容
【题目】Ⅰ.甲硅烷(SiH4)常温下是一种无色气体,遇空气发生自燃。
(1)甲硅烷中含有的化学键是___,其在固态时属于___晶体。
(2)室温下1g甲硅烷燃烧生成SiO2和H2O放热44.6kJ,其热化学方程式为___。
Ⅱ.①CaCO3(s)=CaO(s)+CO2(g) △H=178.2kJmol-1
②2Na(s)+Cl2(g)=2NaCl(s) △H=-822.0kJmol-1
则:
(3)上述反应①②中属于放热反应的是___(填序号)。
(4)根据②计算生成1molNaCl(s)时,△H=___kJmol-1
Ⅲ.氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图。该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
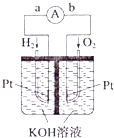
(5)氢氧燃料电池的能量转化形式主要是___。在导线中电子流动方向为___(用a、b表示)。
(6)负极反应式为___。
(7)金属锂是一种重要的储氢材料,吸氢和放氢原理如下:2Li+H2=2LiH,LiH+H2O=LiOH+H2↑,则2mol锂储氢后释放出的H2可以消耗标准状态O2的体积是___L。
【答案】共价键 分子 SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H=-1427.2kJ/mol ② -411.0kJ·mol-1 化学能转化为电能 a→b 2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O 22.4
【解析】
Ⅰ、![]() 由非金属形成的化合物,非金属元素之间的化学键为共价键,
由非金属形成的化合物,非金属元素之间的化学键为共价键,![]() 在常温下为气体,沸点较低,应为分子晶体。答案为:共价键;分子;
在常温下为气体,沸点较低,应为分子晶体。答案为:共价键;分子;
![]() 甲硅烷的物质的量为
甲硅烷的物质的量为![]() ,放出
,放出![]() 的热量,则1mol甲硅烷完全燃烧放出的热量为
的热量,则1mol甲硅烷完全燃烧放出的热量为![]() ,热化学方程式为
,热化学方程式为![]()
![]() 。
。
Ⅱ、![]() 据热化学方程式,
据热化学方程式,![]()
![]() 可知
可知![]() 为吸热反应,
为吸热反应,![]() 为放热反应。答案为:
为放热反应。答案为:![]() ;
;
![]() 生成2molNaCl放出
生成2molNaCl放出![]() 热量,则生成1molNaCl放出其一半的热量,为411kJ热量。答案为:-411.0kJ·mol-1;
热量,则生成1molNaCl放出其一半的热量,为411kJ热量。答案为:-411.0kJ·mol-1;
Ⅲ、![]() 该装置是把化学物质中的能量转化为电能,所以是化学能转变为电能;在原电池中,负极上失电子,正极上得电子,电子的流向是从负极流向正极,所以是由a到b。答案为:化学能转化为电能;
该装置是把化学物质中的能量转化为电能,所以是化学能转变为电能;在原电池中,负极上失电子,正极上得电子,电子的流向是从负极流向正极,所以是由a到b。答案为:化学能转化为电能;![]() ;
;
![]() 该反应中负极上氢气失电子生成氢离子而被氧化,所以电极反应式为
该反应中负极上氢气失电子生成氢离子而被氧化,所以电极反应式为![]() 或
或![]() 。
。
![]() 据吸氢和放氢原理可知,2mol锂储氢后生成2molLiH,释放2mol氢气,2mol氢气能够消耗1mol氧气,1mol氧气在标准状况下体积为
据吸氢和放氢原理可知,2mol锂储氢后生成2molLiH,释放2mol氢气,2mol氢气能够消耗1mol氧气,1mol氧气在标准状况下体积为![]() 。
。

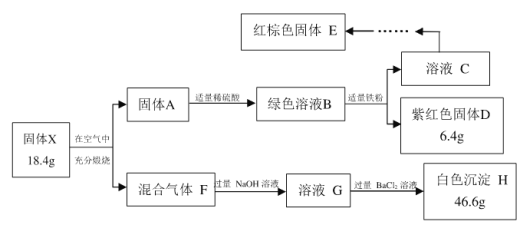
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
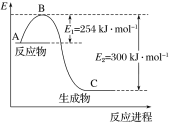
(1)上图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:______________。
(2)若已知下列数据:
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:________ kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-a kJ·mol-1①
N2(g)+O2(g)===2NO(g) ΔH2=-b kJ·mol-1②
若1 mol NH3还原NO至N2,则该反应过程中的反应热ΔH3=________ kJ·mol-1(用含a、b的式子表示)。
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) ![]() (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________。
【题目】W、X、Y、Z是短周期元素,其部分性质如下表:
W | 单质是淡黄色固体 |
X | 在地壳中的含量居第二位 |
Y | 原子最外层电子数是电子总数的 |
Z | 第三周期原子半径最小的金属元素 |
下列说法正确的是
A. 气态氢化物的热稳定性:X>W B. Z的氧化物中含有非极性共价键
C. 离子半径:Z>W D. 最高价氧化物对应水化物的酸性:Y>X