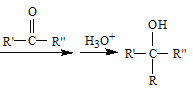题目内容
【题目】下列说法正确的是
A.NH4Cl晶体中只有离子键
B.液态HI受热分解的过程中,只破坏分子间作用力
C.Si3N4和CCl4均属于原子晶体
D.C4H10的2种同分异构体因为分子间作用力大小不同,因而沸点不同
【答案】D
【解析】
A.NH4Cl晶体中既有离子键又有共价键,A错误;
B.液态HI受热分解的过程中发生化学变化![]() ,故不仅仅破坏分子间作用力,还破坏了共价键,B错误;
,故不仅仅破坏分子间作用力,还破坏了共价键,B错误;
C.Si3N4属于原子晶体,而CCl4属于分子晶体,C错误;
D.C4H10的2种同分异构体即正丁烷CH3CH2CH2CH3和异丁烷(CH3)2CHCH3,由于正丁烷中没有支链,故分子间的距离较近,分子间作用力较大,而异丁烷有一个支链,分子间距离较远,分子间作用力较小不同,它们均为分子晶体,因而沸点不同,D正确;
故答案为:D。

练习册系列答案
相关题目