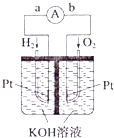
题目内容
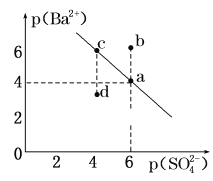
【题目】常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如下图所示,则下列叙述正确的是

A.b、c两点溶液的导电能力相同
B.a、b、c三点溶液中水的电离程度a>c>b
C.c点溶液中c(H+) =c(OH-) +c(CH3COOH)
D.用等浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸体积 Vb = Vc
【答案】B
【解析】
NaOH是强电解质,CH3COONa是强碱弱酸盐,加水稀释促进醋酸根离子水解,稀释相同的倍数时,溶液中c(OH-):CH3COONa>NaOH,所以pH变化大的是NaOH,则b为NaOH,变化小的是CH3COONa,即c为CH3COONa。
A.溶液的导电能力与离子浓度成正比,pH相等的醋酸钠和氢氧化钠,c(CH3COONa)>c(NaOH),所以c点导电能力大于b,即b、c两点溶液的导电能力不相同,故A错误;
B.氢氧化钠对水的电离起抑制作用,而醋酸根离子浓度越大对水的电离程度越促进,所以a、b、c三点溶液中水的电离程度a>c>b,故B正确;
C.任何电解质溶液中都存在质子守恒,根据质子守恒得c(H+)+c(CH3COOH)=c(OH-),故C错误;
D.pH相等的NaOH和CH3COONa溶液,c(CH3COONa)>c(NaOH),相同体积相同pH的醋酸钠和氢氧化钠溶液消耗相同浓度的盐酸体积与氢氧化钠和醋酸钠的物质的量成正比,相同体积相同pH的醋酸钠和氢氧化钠溶液n(CH3COONa)>n(NaOH),所以醋酸钠消耗盐酸多,消耗盐酸体积Vb<Vc,故D错误;故选B。
【点晴】
本题考查了盐类水解,涉及离子浓度大小比较、溶液导电能力大小比较、水的电离程度等知识点,根据溶液中的溶质及其性质是解本题关键,再结合质子守恒、溶液导电能力与离子浓度的关系等知识点来分析解答。