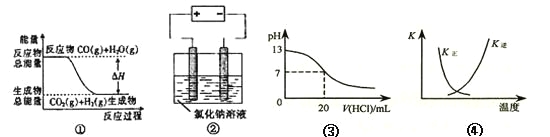
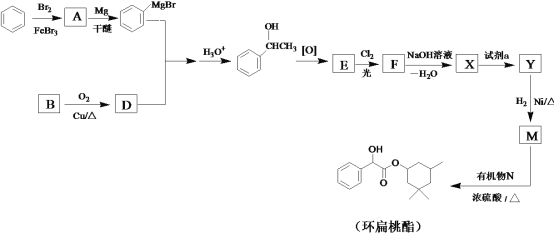
题目内容
【题目】开发新能源和三废处理都是可持续发展的重要方面。
(1)由碳的氧化物直接合成乙醇燃料已进入大规模生产。如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。
CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。
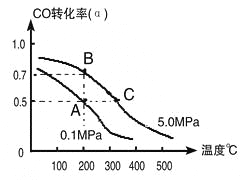
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K=_______;
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA____tC(填“大于”、“小于”或“等于”)。
③工业上还可以采取以CO2和H2为原料合成乙醇,并且更被化学工作者推崇,但是在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数。请推测化学工作者认可由CO2制取CH3CH2OH的优点主要是:_______________。
(2)目前工业上也可以用CO2来生产甲醇。一定条件下发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
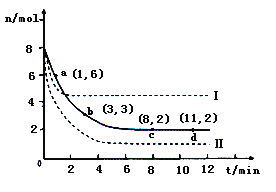
①请在答题卷图中绘出甲醇的物质的量随时间变化曲线_______。
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是_________,曲线Ⅱ对应的实验条件改变是_______。
(3)Hg是水体污染的重金属元素之一。水溶液中二价汞的主要存在形态与Clˉ、OHˉ的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-1gc(Clˉ)]
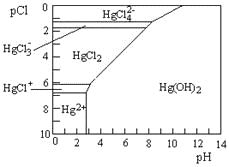
①下列说法中正确的是_____。
A.为了防止Hg2+水解,配制Hg(NO3)2溶液时应将Hg(NO3)2固体溶于浓硝酸后再稀释
B.当c(C1ˉ)=10ˉ1mol·Lˉ1时,汞元素一定全部以HgCl42ˉ形式存在
C.HgCl2是一种弱电解质,其电离方程式是:HgCl2=HgCl++C1ˉ
D.当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2
②HgCl2又称“升汞”,熔点549K,加热能升华,其晶体是_____(填晶体类型)。
【答案】0.25 大于 原料易得、可以减轻温室效应等  升温 增压 AD ②分子晶体
升温 增压 AD ②分子晶体
【解析】
(1)①
根据化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值可知,该温度下反应的平衡常数K=![]() =0.25。
=0.25。
②根据图像可知,C点温度和压强均大于A点温度和压强,所以C点反应速率快,达到平衡的时间少。
③由于CO2易造成温室效应,所以该方法的优点是原料易得、可以减轻温室效应。
(2)①根据图像可知平衡时氢气的物质的量是2mol,消耗氢气的物质的量是8mol-2mol=6mol,所以根据方程式可知平衡时生成甲醇的物质的量是2mol,因此图像可表示为 。
。
②曲线I与原曲线相比达到平衡的时间减少,说明反应速率快。而平衡时氢气的物质的量增加,说明平衡向逆反应方向移动。由于正方应是体积减小的可逆反应,所以改变的条件只能是升高温度,即正方应是放热反应;曲线Ⅱ与原曲线相比达到平衡的时间减少,说明反应速率快。而平衡时氢气的物质的量减少,这说明平衡向正反应方向移动。由于正方应是体积减小的放热的可逆反应,所以改变的条件只能是增大压强。
(3)①A.Hg2+水解溶液显酸性,所以为了防止Hg2+水解,配制Hg(NO3)2溶液时应将Hg(NO3)2固体溶于浓硝酸后再稀释,A正确;B.当c(C1ˉ)=10ˉ1mol·Lˉ1,即pCl=1时,汞元素主要是以HgCl42ˉ形式存在,B不正确;C.HgCl2是一种弱电解质,其电离方程式是:2HgCl2![]() HgCl++HgCl3ˉ,C不正确;D.根据图像可知当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2,D正确,答案选AD。
HgCl++HgCl3ˉ,C不正确;D.根据图像可知当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2,D正确,答案选AD。
②HgCl2又称“升汞”,熔点549K,加热能升华,这说明晶体是分子晶体。

【题目】“84”消毒液(工业利用Cl2与NaOH反应制得)可用于消毒和漂白,下列实验现象的分析不正确的是
实验操作 |
|
|
|
实验现象 | 混合后溶液的pH=9.9,短时间内未褪色,一段时间后蓝色褪去。 | 混合后溶液pH=5.0,蓝色迅速褪去,无气体产生。 | 混合后溶液pH=3.2,蓝色迅速褪去,并产生大量气体,使湿润的淀粉碘化钾试纸变蓝。 |
A.对比实验①和②,②中蓝色迅速褪去的原因是发生了反应ClO+H+═HClO
B.实验③中产生的气体是Cl2,由HClO分解得到:2HClO═Cl2↑+H2O
C.对比实验②和③,溶液的pH可能会影响ClO的氧化性或Cl的还原性
D.加酸可以提高“84”消毒液的漂白效果,但需要调控合适的pH才能安全使用