题目内容
【题目】某黄色矿物中主要成分X仅含三种元素,不含结晶水,某研究小组为了探究X的组成和性质,设计并完成了如下实验:
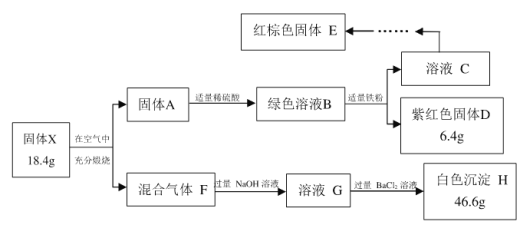
注:适量代表该试剂恰好完全反应
(1)固体X中所含元素有Fe、S和___________,其化学式为___________;
(2)F→G的总离子方程式(只写一步)是_____________________________________,该反应的还原剂是_______________。
【答案】Cu CuFeS2 2SO2+O2+4OH-=2![]() +2H2O SO2
+2H2O SO2
【解析】
根据图中可知:溶液B为绿色,则含有二价铁离子,固体D为紫红色,则D为铜单质,铜元素的物质的量为:![]() ;固体E为红棕色,E为Fe2O3;加入BaCl2生成白色沉淀,应该为BaSO4,混合气体中有二氧化硫和氧气,故沉淀不能为BaSO3,硫元素的物质的量为:
;固体E为红棕色,E为Fe2O3;加入BaCl2生成白色沉淀,应该为BaSO4,混合气体中有二氧化硫和氧气,故沉淀不能为BaSO3,硫元素的物质的量为:![]() ,铁元素的质量为:18.4g-6.4g-0.2g×32g/mol=5.6g,铁元素的物质的量为:
,铁元素的质量为:18.4g-6.4g-0.2g×32g/mol=5.6g,铁元素的物质的量为:![]() ,以此解题。
,以此解题。
(1)根据元素守恒和分析知,固体X中所含元素有Fe、S和Cu, Cu、Fe和S的物质的量比为:0.01:0.01:0.02=1:1:2,所以化学式为CuFeS2;
(2)F→G为中涉及到二氧化硫与氢氧化钠反应生成亚硫酸钠,亚硫酸钠与氧气反应生成硫酸钠,总离子方程式是2SO2+O2+4OH-=2![]() +2H2O,该反应中SO2化合价升高,所以还原剂是SO2。
+2H2O,该反应中SO2化合价升高,所以还原剂是SO2。

练习册系列答案
相关题目