题目内容
【题目】设NA为阿伏加德罗常数的数值。下列说法正确的有
① 3 mol单质Fe完全转化为Fe3O4,失去9NA个电子
② 标准状况下,11.2LCl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
③ 32gS8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
④常温常压下,0.5 mol Fe和足量浓硝酸混合,转移电子数为1.5NA
⑤ 1L0.1mol·L-1 NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
⑥浓硫酸(含1molH2SO4)与足量Cu加热发生反应生成0.5NA个SO2分子
⑦标准状况下,22.4 L N2和H2的混合气休中含有NA个原子
⑧23gNa与足量H2O反应完全后可生成NA个氢气分子
A. 一项B. 两项C. 三项D. 四项
【答案】A
【解析】
①Fe3O4中铁元素的化合价为+![]() ,因此3mol单质铁完全转化成Fe3O4,失去电子物质的量为3mol×(
,因此3mol单质铁完全转化成Fe3O4,失去电子物质的量为3mol×(![]() -0)=8mol,故①不正确;
-0)=8mol,故①不正确;
②氯气溶于水,只有少量的Cl2与水发生反应,氯元素存在的形式为Cl2、Cl-、ClO-、HClO,故②不正确;
③1molS8中含有共价键的物质的量为8mol,则32gS8中含有共价键的物质的量为![]() =1mol,故③正确;
=1mol,故③正确;
④常温下铁和浓硝酸发生钝化反应,产生致密的氧化薄膜阻碍反应的进行,故④不正确;
⑤碳元素在溶液存在形式有CO32-、HCO3-、H2CO3,根据物料守恒,得出n(CO32-)+n(HCO3-)+n(H2CO3)=1L×0.1mol·L-1=0.1mol,故⑤不正确;
⑥Cu是足量,随着反应的进行,硫酸的浓度逐步降低,反应将会停止,生成SO2的物质的量小于0.1mol,故⑥不正确;
⑦无论氮气还是氢气,都是双原子分子,标准状况下,22.4L的该混合气体中含有2mol原子,故⑦不正确;
⑧Na与H2O发生:2Na+2H2O=2NaOH+H2↑,23gNa与足量水完全反应后,生成氢气的物质的量为![]() =0.5mol,故⑧不正确;
=0.5mol,故⑧不正确;
综上所述选项A正确;
答案为A。

【题目】(1)已知Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=2.6×10-39。常温下,某酸性CuCl2溶液中含有少量的FeCl3,为了得到纯净的CuCl2·2H2O晶体,应加入___________(填氧化物的化学式),调节溶液的pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
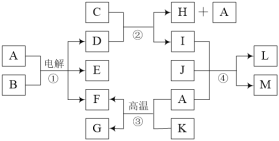
(2)某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗涤液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
①用稀盐酸溶解碳酸钙的离子方程式是_____________________________。
②已知:25 ℃时有关物质的溶度积
物质 | CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
Ksp | 2.8×10-9 | 9.1×10-6 | 1.8×10-11 | 6.8×10-6 |
根据数据,结合化学平衡原理解释清洗CaSO4的过程________________。(用溶解平衡表达式和必要的文字叙述加以说明);在步骤Ⅰ浸泡过程中还会发生反应MgCO3(s)+2OH-(aq)![]() Mg(OH)2(s)+CO32-(aq),该反应的平衡常数K=________(保留两位有效数字)。
Mg(OH)2(s)+CO32-(aq),该反应的平衡常数K=________(保留两位有效数字)。
③步骤Ⅲ中,加入Na2SO3溶液的目的是_______________________________。
【题目】今有一澄清溶液,只可能含有下表中的若干种离子(存在的离子均大量):
阳离子 | K+、NH4+、H+、Ba2+ |
阴离子 | Cl-、CO32-、SO42-、OH- |
现取三份上述澄清溶液各100 mL,分别进行以下实验:
①第一份加入AgNO3溶液有沉淀产生。
②第二份加入足量NaOH溶液加热后,收集到气体0.04 mol。
③第三份加入足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤,干燥后,沉淀质量为2.33 g。
请回答下列问题:
(1)根据第②个实验可以确定存在的离子是_______;
(2)除(1)中确定存在的离子以外,还一定存在的离子是__________,可能存在的离子是______;
(3)第③个实验中沉淀减少的原因是(用离子方程式表示)______________。