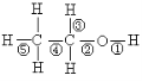
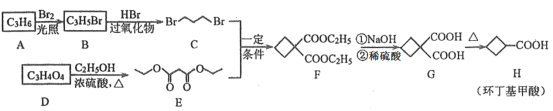
题目内容
【题目】石油是工业的血液,与我们的生产、生活息息相关。
完成下列填空:
(1)可用来衡量一个国家石油化工发展水平的是__________的产量。
A.乙烷 B.乙烯 C.甲烷
(2)乙烯能使溴水褪色,说明乙烯能发生__________反应。
A.取代 B.加成 C.氧化还原
(3)甲烷和氯气在光照条件下能发生反应,反应的其中一个方程式如下:
CH4 + Cl2 → CH3Cl + HCl ,该反应属于__________反应。
A.取代 B.加成 C.氧化还原
(4)下列与异戊烷如图,互为同分异构体的是(_______)
![]()
A. 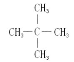 B.
B.![]() C.
C.
(5)聚乙烯安全无毒,可用于生产食品包装袋。聚乙烯的结构简式为(_______)
A.CH2=CH2 B.![]() C.
C. ![]()
(6)同系物结构相似,在分子组成上相差一个或若干个CH2原子团,请写出任意一个甲烷的同系物的结构简式。_____________
【答案】B B A A B 所有的烷烃
【解析】
甲烷与氯气在光照条件下发生取代反应,这是烷烃的特征反应。判断同分异构体时,既要看是否“同分”,又要看是否“异构”。
(1)乙烯是石油的深加工的产品。乙烯的产量反应了一个国家石油化工发展水平高低,所以答案选择B项;
(2)乙烯中含有碳碳双键可以发生加成反应,所以答案选择B项;
(3)氯气中的氯原子取代了甲烷上的氢原子,该反应是取代反应,所以答案选择A项;
(4)此题中单看碳原子数只有A项符合,可直接确定答案是A项;
(5)A为乙烯结构简式,B为聚乙烯结构简式,C为左侧碳不满足碳四价,所以答案选择B项;
(6)所有的烷烃分子式均满足CnH2n+2,与甲烷相差n个CH2原子团,所以除了甲烷之外的所有烷烃与甲烷都是同系物,答案符合CnH2n+2 (n>1)均为正确答案。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目