题目内容
10.下列比较中正确的是( )①沸点:乙烷<乙醇 ②沸点:正戊烷>异戊烷 ③相对密度:1-丁烯>1-庚烯.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①②③ |
分析 ①含有氢键的物质熔沸点较高;
②烷烃同分异构体中,含有支链越多其熔沸点越低;
③单烯烃的密度随着C原子个数增大而增大.
解答 解:①含有氢键的物质熔沸点较高,乙醇中含有氢键、乙烷中不含氢键,所以熔沸点:乙烷<乙醇,故正确;
②烷烃同分异构体中,含有支链越多其熔沸点越低,正戊烷没有支链、异戊烷含有一个支链,所以沸点:正戊烷>异戊烷,故正确;
③单烯烃的密度随着C原子个数增大而增大,所以相对密度:1-丁烯<1-庚烯,故错误;
故选A.
点评 本题考查分子晶体熔沸点、密度大小比较,侧重考查学生分析判断能力,分子晶体熔沸点与相对分子质量、氢键有关,烷烃、烯烃都还与支链有关,题目难度不大.

练习册系列答案
相关题目
20.能确定为丙烯的化学用语是( )
| A. | C3H6 | B. | 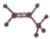 | C. | 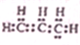 | D. | CH2=CH-CH3 |
1.下列实验不能作为判断依据的是( )
| A. | Na和Mg分别与冷水反应,判断钠和镁金属性强弱 | |
| B. | 硅酸钠溶液通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱 | |
| C. | F2与Cl2分别于足量的H2反应,判断氟和氯的非金属性强弱 | |
| D. | 在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属性强弱 |
5.甲烷燃料电池以铂丝为电极,KOH为电解质溶液,从两极分别通入甲烷和氧气即可产生电流.关于此燃料电池的下列叙述正确的是( )
| A. | 通入CH4的电极为正极 | |
| B. | 正极的电极反应式为:202+8e-+4H20=80H- | |
| C. | 若甲烷通人量为1.12L(标准状况)且反应完全,则电池中有0.1mol02被氧化 | |
| D. | 通入甲烷的电极的电极反应式为:CH4+202+4e-=C02+2H20 |
15.中草药陈皮中含有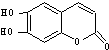 具有抗菌作用.1mol该物质与足量的NaOH溶液反应,消耗NaOH的物质的量是( )
具有抗菌作用.1mol该物质与足量的NaOH溶液反应,消耗NaOH的物质的量是( )
 具有抗菌作用.1mol该物质与足量的NaOH溶液反应,消耗NaOH的物质的量是( )
具有抗菌作用.1mol该物质与足量的NaOH溶液反应,消耗NaOH的物质的量是( )| A. | 1mol | B. | 2 mol | C. | 3 mol | D. | 4 mol |
2.以乙醇为主要原料制乙二醛时,经过的反应为( )
| A. | 取代-消去-加成-氧化 | B. | 消去-加成-取代-氧化 | ||
| C. | 消去-取代-加成-氧化 | D. | 取代-加成-氧化-消去 |
19.阿佛加德罗常数用NA表示,下列叙述正确的是( )
| A. | 室温时,1L pH=2的NH4Cl溶液中水电离出10-12 molH+ | |
| B. | 常温常压下,46g NO2含有的原子数等于3NA | |
| C. | 12g石墨含有4NA个自由移动的电子 | |
| D. | 22.4LCl2与足量NaOH反应,转移电子数NA |
 .
. .
.