题目内容
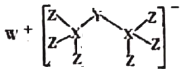
【题目】最近科学家合成出了一种由W、X、Y、Z组成的新化合物(如图所示)。W、X、Y、Z为同一短周期元素,W元素焰色为黄色,水体中Y元素含量高会导致水体富营养化,Z的单质常用于给自来水消毒,其核外最外层电子数是X核外电子数的一半。
据此回答下列问题:
(1)X在周期表中的位置为_____。
(2)W、Y、Z形成的简单离子半径从大到小的顺序为_____(用离子符号表示)
(3)Y所在主族的元素形成的最简单氢化物,沸点最低的为_____(填化学式),YZ3中所含化学键为_____ (填“离子键”或“共价键”)
(4)写出证明非金属性Z大于X的判据_____ (任写一条)
(5)实验室中制备Z的单质的离子反应方程式为_____。
【答案】第三周期 Ⅳ A族 P3﹣>Cl﹣>Na+ PH3 共价键 简单氢化物稳定性:HCl>SiH4(或最高价氧化物对应水化物的酸性:HClO4>H2SiO3) MnO2+4H++2Cl﹣![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
【解析】
根据元素性质及核外电子排布情况分析元素的种类;根据元素周期表的结构及元素周期律分析解答;根据氯气的实验室制备原理分析解答。
W、X、Y、Z为同一短周期元素,W元素焰色为黄色,则W为钠;水体中Y元素含量高会导致水体富营养化,则Y为氮或磷元素,Z的单质常用于给自来水消毒,则Z为氯;氯最外层电子水为7,是X核外电子数的一半,则X核外电子数为14,X为硅,则Y为磷。
(1)Si的原子序数为14,位于元素周期表中第三周期ⅣA族,故答案为:第三周期ⅣA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,则离子半径:P3->Cl->Na+,故答案为:P3->Cl->Na+;
(3)P位于ⅤA,由于氨气分子间存在氢键,其沸点较高;其它氢化物属于分子晶体,相对分子质量越大沸点越高,属于ⅤA族元素形成的氢化物中沸点最低为PH3; PCl3属于共价化合物,其分子中只存在共价键,故答案为:PH3;共价键;
(4)简单氢化物稳定性:HCl>SiH4(或最高价氧化物对应水化物的酸性:HClO4>H2SiO3),证明非金属性:Cl>Si,故答案为:简单氢化物稳定性:HCl>SiH4(或最高价氧化物对应水化物的酸性:HClO4>H2SiO3);
(5)实验室中加热浓盐酸与二氧化锰制备氯气,发生反应的离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案