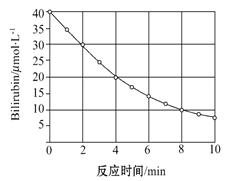
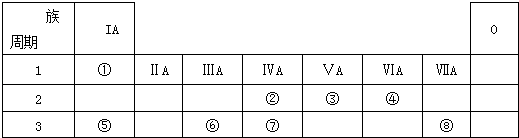
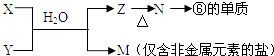��Ŀ����
����Ŀ��(NH4)2Fe(SO4)2��6H2O (Ī���Σ�dz��ɫ������Ҫ�Ļ���ԭ�Ϻͻ�ѧ�Լ���ij����С��Ϊ��̽��Ī���εķֽ�����չ������ʵ�飺
��1������ͬѧ���룺Ī���εķֽ���������N2��Fe2O3��SO3��H2O�������ʡ����Ƿ�ͬ�����ͬѧ�IJ��룬��˵�����ɣ�______________________��
��2������ͬѧ��������ͼ��ʾ��װ�ý���ʵ�飬�ر�ֹˮ�У�����A�е�Ī���ι������ֽ���ȫ��������ֽ���

��װ��B������������______________����ʢ�Լ���_________________��
��װ��C�пɹ۲쵽��������________________�� �ɴ˿�֪��������立ֽ�IJ�������___________��
��3������ͬѧѡ������ʵ���е�װ��A����ͼ��ʾ��װ�ã�����ʵ����֤Ī���ηֽ�IJ����л���SO2��SO3��

�ٱ���ͬѧ��ʵ��װ���У��������ӵĺ���˳��ΪA______________(��װ����ĸ��ʾ)��ȡ����������A�У�ͨ�� N2һ��ʱ��ر�ֹˮ�У�Ƚ��ȼ�ƾ��ơ�ͨ��N2��Ŀ����___________________ ��
����װ��H���а�ɫ�������ɣ���֤���ֽ��������__________________����֤���ֽ��������SO2��ʵ��������___________________ ��
��4������ͬѧ��һ������Ī������500���ĸ���������������ʱ���������������ʵ��֤�����˹�����ﲻ����������_______________________��
���𰸡� �� �� �� �� �� �� �� �� �� ��
��������������Ҫ�������̽��Ī���εķֽ����ʵ������ۡ�
(1)��ͬ�⣬��Ӧ��Ԫ�ػ��ϼ۵ı仯ΪN��-3��0��Fe��+2��+3��ֻ��N��Fe���ϼ����ߣ�û��Ԫ�ػ��ϼ۽�����
(2)��װ��B�����������Ǹ���ܣ���ʢ�Լ��ǹ���������ʯ����
��װ��C�������ﰱ������ˮ�γɰ�ˮ���ɹ۲쵽����������Һ����ɫ��Ϊ��ɫ���ɴ˿�֪��������立ֽ�IJ�������NH3��
(3)�ٱ���ͬѧ��ʵ��װ���У��������Ҫ��ͨ��������װ��D����ͨ��H����SO3��SO2��H�мȲ���ӦҲ���ܽ⣬����ͨ��Eȷ��SO3�ѳ���������ͨ��G����SO2����G��SO2��H2O2��������H2SO4���Ӷ��������ᱵ����������������ͨ����������װ��F����ˣ��������ӵĺ���˳��ΪA��D��H��E��G��F��ͨ��N2��Ŀ���Ǹ���װ���еĿ�������ֹ��SO2����֤����������
����װ��H���а�ɫ�������ɣ���֤���ֽ��������SO3����֤���ֽ��������SO2��ʵ��������E������������G�г��ְ�ɫ������
(4)���������л�ԭ�ԣ���ʹ���Ը��������Һ��ɫ���ݴ����ʵ��Ϊ��ȡ������Ʒ����������ϡ���ᣬ�������� KMnO4��Һ����Һ����ɫ��

 ������������ϵ�д�
������������ϵ�д�����Ŀ��һ���¶��£���2.5L�ĺ����ܱ������з������·�Ӧ��CO2(g)+H2S(g)![]() COS(g)��H2O(g)
COS(g)��H2O(g)
ʵ�� | �¶�/K | ��ʼ���ʵ���/mol | ƽ�����ʵ���/mol | ƽ�ⳣ�� | |
CO2 | H2S | H2O | |||
I | 607 | 0.11 | 0.41 | 0.01 | |
II | 607 | 0.22 | 0.82 | ||
III | 620 | 0.1 | 0.4 | 6.74��10-3 | |
����˵������ȷ������ ��
A. �÷�Ӧ����ӦΪ���ȷ�Ӧ
B. 607Kʱ�������ʵ�����Ϊ0.1mol���ַ�Ӧ�����÷�Ӧ���У���Ӧ��������Ӧ�������
C. ʵ�����ﵽƽ��ʱ������COS�����ʵ���Ϊ0.02mol
D. ʵ�����У������ǿ�ʼ��������ѧƽ��״̬�����������ܶ�ʼ�ղ���