题目内容
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)![]() 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如图所示。请回答下列问题:
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如图所示。请回答下列问题:
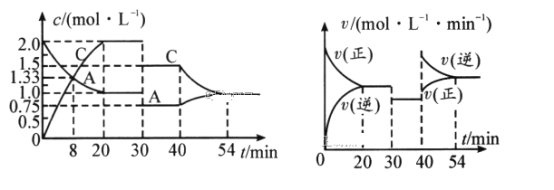
(1)0~20min,A的平均反应速率为__mol/(L·min);8min时,v正__v逆(填“>”“=”或“<”)。
(2)反应方程式中的x=__,30min时改变的反应条件是__。
(3)20~30min时反应的平衡常数__(填“>”“=”或“<”)3040min时反应的平衡常数。
(4)该反应的正反应为__(填“放热”或“吸热”)反应。
(5)反应过程中B的转化率最大的时间段是_min。
【答案】0.05 > 1 扩大容器容积(或减小压强) = 放热 20-40
【解析】
反应从开始到20min,A的浓度变化量为1.0mol/L,C的浓度变化量为2mol/L,30min时,改变条件,此时A的浓度变为0.75mol/L,C的浓度变为1.5mol/L,都为30min时的0.75倍,所以改变的条件应为减压,但平衡没发生移动,则表明反应前后气体的分子数相等,由此得出x=1;40min时改变某条件,使正、逆反应速率都增大,平衡逆向移动,所以此条件应为温度,升高温度,平衡逆向移动,则表明正反应为放热反应。
(1)0~20min,A的平均反应速率为![]() =0.05mol/(L·min);8min时,A的浓度继续减小,表明反应仍正向进行,所以v正>v逆。答案为:0.05;>;
=0.05mol/(L·min);8min时,A的浓度继续减小,表明反应仍正向进行,所以v正>v逆。答案为:0.05;>;
(2)因为减压平衡不发生移动,所以反应前后气体的分子数相等,由此得出反应方程式中的x=1;由以上分析知,30min时改变的反应条件是扩大容器容积(或减小压强)。答案为:1;扩大容器容积(或减小压强);
(3)20~30min与3040min时反应的平衡常数相等,因为只改变压强,而温度不变。答案为:=;
(4)升高温度时,平衡逆向移动,则该反应的正反应为放热反应。答案为:放热;
(5)因为40min后平衡逆向移动,B的转化率减小,所以反应过程中B的转化率最大的时间段是20~40min。答案为:20~40。

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案