题目内容
19.下列关于某些电解质溶液的判断中,正确的是( )| A. | 0.1mol/LNaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 等浓度等体积的Na2CO3溶液与NaClO溶液混合后:2c(Na+)=3c(ClO-)+3c(HClO)+3c(HCO3-)+3c(CO32-)+3c(H2CO3) | |
| C. | 室温下,KOH与苯酚混合pH=7的溶液中:c(K+)>c(C6H5O-)>c(H+)=c(OH-) | |
| D. | 某温度下,水的离子积常数Kw=10-13,在此温度下,将pH=12的NaOH溶液Va L与pH=2的硫酸Vb L混合,所得溶液呈中性,则Va:Vb=10:1 |
分析 A、NaHCO3溶液显碱性,碳酸氢根离子的水解程度大于其电离程度;
B、据物料守恒分析;
C、据电荷守恒分析;
D、根据反应后的溶液显中性,氢离子与氢氧根离子物质的量相同进行计算.
解答 解:A、碳酸氢根离子的水解程度大于其电离程度,所以NaHCO3溶液中c(H2CO3)>c(CO32-),故A错误;
B、Na2CO3溶液中c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3),NaClO溶液中c(Na+)=c(ClO-)+c(HClO),等浓度等体积的Na2CO3溶液与NaClO溶液混合后,碳酸钠中的c(Na+)是次氯酸钠中的2倍,所以2c(Na+)=3c(ClO-)+3c(HClO)+3c(HCO3-)+3c(CO32-)+3c(H2CO3),故B正确;
C、据电荷守恒,室温下,KOH与苯酚混合pH=7的溶液中:c(K+)=c(C6H5O-)>c(H+)=c(OH-),故C错误;
D、水的离子积常数Kw=10-13,在此温度下,将pH=12的NaOH溶液中c(OH-)=0.1mol/L,pH=2的硫酸中c(H+)=0.01mol/L,混合后溶液显中性,所以Va L×0.1mol/L=0.01mol/L×Vb L,Va:Vb=1:10,故D错误;
故选B.
点评 本题考查了离子浓度大小的比较以及pH的计算,做题时注意把握水的离子积常数随温度的变化而变化和溶液中的电荷守恒、物料守恒,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列说法不正确的是( )
| A. | Na+的结构示意图为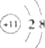 | |
| B. | 纯碱的化学式为Na2CO3 | |
| C. | 在酸性条件下,蔗糖水解的化学方程式为C12H20O11+H2O→2C6H12O6(葡萄糖) | |
| D. | 高氯酸(HClO4)中氯元素的化合价为+7 |
7.下列所述的操作中没有涉及到化学变化的是( )
| A. | 豆科作物的根瘤菌对空气中氮的固定 | |
| B. | 将NO2气体冷却后颜色会变浅 | |
| C. | 通过煤的液化来提取苯、二甲苯等化工原料 | |
| D. | 工业制液态氧 |
14.化学与生产、生活密切相关.下列说法中正确的一项是( )
| A. | PM2.5(直径小于或者等于2.5×10-6m的细颗粒物)分散在空气中形成的溶胶 | |
| B. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 自来水厂可使用Cl2和绿矾(FeSO4•7H2O) 进行自来水的消毒、净化,以改善水质 | |
| D. | 在食品包装袋中放入装有硅胶的透气小袋,可以防止食物氧化变质 |
4.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 一定条件下6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2 NA | |
| B. | 1 mol AlCl3在熔融状态时离子总数为0.4NA | |
| C. | 标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA | |
| D. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA |
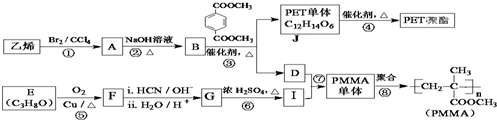
 $→_{ii.H_{2}O/H+}^{i.HCN/OH-}$
$→_{ii.H_{2}O/H+}^{i.HCN/OH-}$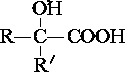 (R、R′代表烃基)
(R、R′代表烃基) $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +2H2O.
+2H2O. .
. 、
、 、
、 .
.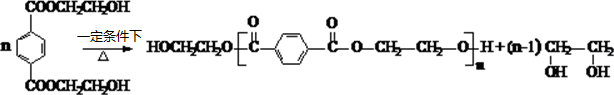 .
.